国产碳离子系统治疗54例肺癌临床分析
国产碳离子系统治疗54例肺癌临床分析
中华放射肿瘤学杂志 2024 年4 月第 33 卷第 4 期 Chin J Radiat Oncol, April 2024, Vol. 33, No. 4
潘鑫1 张一贺1 马彤1 王馨1 杨钰玲1 秦天燕2 吕彩霞2 李鹏庆2 叶延程1 张雁山1
1甘肃省武威肿瘤医院重离子中心放疗科,武威 733000;2甘肃省武威肿瘤医院肿瘤登记/随访中心,武威 733000
通信作者:张雁山,Email:13830510999@163.com
【摘要】 目的 探讨碳离子治疗早期(Ⅰ期)和局部晚期(Ⅱ‐Ⅲ期)肺癌的治疗预后情况并分析预后影响因素。方法 回顾性分析2020年3月至2022年9月在甘肃省武威肿瘤医院重离子中心完成碳离子治疗、随访的 54 例肺癌患者的一般临床资料、治疗、不良反应以及生存情况等资料。采用Kaplan‐Meier法绘制生存曲线,log‐rank法进行差异检验,并采用logistic回归对影响患者预后的因素进行分析。结果 根据入选、排除标准共纳入 54例患者,其中早期肺癌患者 10例,局部晚期肺癌患者44例。10例早期肺癌患者中位随访时间为 11.0(6.75,17.25)个月,照射中位剂量为 60 Gy[相对生物效应(RBE)],至末次随访,3例完全缓解,3例部分缓解;4例病情稳定,没有出现病情进展的患者,1、2 年局部控制率(LCR)、无进展生存(PFS)率、总生存(OS)率均为 100%。治疗及随访期间,出现 2 例1级放射性肺炎,1例2级放射性肺炎、1例胸壁损伤(胸壁疼痛),没有2级以上的不良反应。44例局部晚期患者中位随访时间为 12.5(4.25,21.75)个月,照射中位剂量为 72 Gy(RBE),治疗过程中 32 例(73%)患者采用同步放化疗,放疗后有20例(45%)患者接受了序贯化疗、14例(32%)患者接受了免疫维持治疗、3 例(7%)患者病情进展采用了靶向药物治疗。至末次随访,3 例(7%)完全缓解,17 例(39%)部分缓解,19例(43%)病情稳定,5例(11%)病情进展。1、2年LCR分别为96.0%、87.3%;1、2年PFS率分别为90.9%、84.1%;1、2年OS率分别为93.2%、86.4%;患者中位OS、PFS尚未达到。多因素分析显示放疗后维持治疗(P=0.027)、CTV 照射体积(P=0.028)是影响 PFS 的因素;同步放化疗(P=0.042)、放疗后维持治疗(P=0.020)是影响 OS 的因素;肿瘤靶体积(GTV)≥215 ml(P=0.068)可能是发生 2 级以上放射性肺炎的独立危险因素。结论 碳离子系统治疗早期和局部晚期肺癌临床效果确切、不良反应可控,联合同步化疗以及治疗后进一步维持治疗明显改善患者预后,且不良反应没有显著增加。
【关键词】 放射疗法; 碳离子; 肺肿瘤,早期; 肺肿瘤,局部晚期; 不良反应; 治疗结果
基金项目:甘肃省科技重点研发计划‐社会发展类 重离子治疗中心项目建设(19YF3FH001);甘肃省自然科学基金‐2021年甘肃省科技厅创新基地和人才计划项目(21JR7RH896)
肺癌是最常见的肿瘤之一,在美国每天约有350人死于肺癌,已被确定为美国第二大常见肿瘤,并居男性和女性肿瘤相关死亡原因的首位[1]。中国的统计数据显示,中国每年约有63.1万人死于肺癌[2]。一些西方国家的肺癌发病率在下降,但在中国仍呈上升趋势。碳离子疗法,又称碳离子辐射疗法,是重离子放疗的一种,被归类为粒子治疗。而光子放疗常被称为常规放疗,光子束的特性完全不同于粒子束(如质子和碳离子)。在目前的临床实践中,碳离子是最常用的重离子,所以日常交流中往往把碳离子和重离子混淆使用。目前,全球在运行的粒子治疗中心共有67家,其中质子中心62家、碳离子中心5家、质子和碳离子兼有者6家(数据来自国际粒子治疗协作组网站www.ptcog.ch)。日本国立放射线医学综合研究所(National Institute of Radiological Sciences,NIRS)是最早开展碳离子治疗并在相关领域积累经验最多的中心之一,其采用碳离子在临床上进行肺癌治疗已有近30年。NIRS在1994年开始了周围型早期非小细胞肺癌(non‐small cell lung cancer,NSCLC)的剂量升级研究(18次/6周治疗)。NIRS在1994—1999年进行了一个肿瘤Ⅰ期周围型NSCLC的Ⅰ‐Ⅱ期剂量升级临床试验并最终确定最佳剂量,明确了大分割碳离子放射治疗的可行性[3]。1995—2015年期间治疗了141例局部晚期NSCLC患者:2年局部控制率(local control rate,LCR)、无进展生存(progression free survival,PFS)率和总生存(overall survival,OS)率分别为80.3%、40.2%和58.7%;不良反应方面,1例(0.7%)出现4级(纵隔出血)、5例(3.5%)出现3级(放射性肺炎)、1例(0.7%)出现3级(支气管瘘)不良反应。这验证了碳离子治疗局部晚期NSCLC的有效性和可接受的不良反应。特别是对老年患者或有合并症而不能接受手术治疗及普通放化疗的患者,碳离子治疗同样显示了安全性和有效性[4]。2020年3月,中国首台国产重(碳)离子肿瘤治疗系统在甘肃省武威肿瘤医院重离子中心正式投入临床应用。本研究回顾性分析了我中心碳离子治疗的54例肺癌患者的临床治疗及随访情况。
资料与方法
1.一般情况:回顾性分析甘肃省武威肿瘤医院重离子中心2020年3月至2022年9月完成碳离子治疗和随访的54例肺癌患者的临床资料。纳入标准:组织学诊断的非小细胞肺癌患者,采用头颅MR、胸部CT和正电子发射计算机体层成像(positron emission computed tomography,PET-CT)进行分期(美国癌症联合委员会第8版);卡诺夫斯凯计分70~100分;可测量实体肿瘤;不愿手术、不可手术或拒绝手术;未合并其他进展期肿瘤。排除标准:怀疑侵犯气管、大血管、心脏或隆突的肺肿瘤;随访资料不完整。本研究经甘肃省武威肿瘤医院伦理委员会审批通过(批件号:2021-伦理审查-05)。
2.碳离子治疗
(1)治疗前定位:患者使用胸部热塑体膜和真空垫固定体位,根据肿瘤的位置采用仰卧位或俯卧位进行CT扫描,层厚和层距均为3mm,扫描部位是从患者的环甲膜到第1腰椎的下缘,并进行四维CT扫描判断呼吸动度。
(2)靶区勾画:采用统一标准勾画靶区(必要时需融合MR或PET-CT)。大体肿瘤体积(gross tumor volume,GTV):影像学可见的大体肿瘤(参考增强CT、MRI或PET-CT)。GTVnd为纵隔转移淋巴结,其定义为短轴直径≥1cm和/或PET-CT扫描阳性者和/或超声内镜等诊断阳性者。早期(Ⅰ期)肺癌:临床靶区(clinical target volume,CTV)为GTV外扩0.5cm,内靶区(internal target volume,ITV)为四维CT可见的CTV移动范围,计划靶区(planning target volume,PTV)为ITV外扩3~5mm,危及器官处适当调整,处方剂量为60~76Gy[相对生物效应(relative biological effect,RBE)]分3~12次。局部晚期肺癌(ⅡA-ⅡB期、ⅢA-ⅢC期):采用选择野照射(elective node radiation,ENI),CTV为包括GTV+GTVnd外0.5cm及预防性淋巴结引流区(转移淋巴结累及野基础上加上根据淋巴结转移的风险度进行预防照射的范围,一般为Ⅱ、Ⅳ、Ⅴ、Ⅶ组淋巴结区域),危及器官处适当调整;ITV为四维CT可见的CTV移动范围;PTV1为ITV外扩3~5mm,处方剂量为48Gy(RBE)分12~16次;PTV2为GTV在四维CT下勾画形成后再外扩0.5cm形成,用于原发肿瘤局部推量,处方剂量为20~28Gy(RBE)分4~7次。患者治疗过程先进行PTV1照射,后序贯进行PTV2照射,最终阳性淋巴结及预防淋巴结引流区照射剂量达到48Gy(RBE),原发肿瘤总剂量达68~76Gy(RBE)。危及器官剂量限制参考日本NIRS:主支气管Dmax<60Gy(RBE),食管Dmax<50Gy(RBE),脊髓Dmax<30Gy(RBE),采用水平、垂直野碳离子束照射。
3.系统综合治疗:患者均经过多学科诊疗会诊,患者治疗过程中参考新版的美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)指南及中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)指南关于系统综合治疗方案的推荐意见,结合患者病情选择相应同步化疗方案以及治疗后维持治疗方案。
4.疗效评估及不良反应评价:患者随访从放疗结束第1天开始,前2次每个月行CT扫描,后每3个月随访1次,随访至2022年9月30日。患者临床观察期间,急性期不良反应采用常见不良事件评价标准第5版进行评价,晚期不良反应采用美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)标准评价。根据实体瘤疗效评价标准1.1版判定疗效。LCR=(完全缓解+部分缓解+病情稳定)/可评价病例数×100%;PFS定义为放疗开始至发生疾病进展或任何原因死亡的时间;OS定义为放疗开始至任何原因死亡或最后一次随访的时间。
5.统计学分析:使用SPSS 22.0软件进行统计分析。符合正态分布的数据,使用x̄±s表示,非正态分布数据采用M(Q1,Q3)表示,占比使用百分比表示,采用t检验、卡方检验分析计数资料,使用Kaplan-Meier法进行生存分析,log-rank法进行差异检验。采用多因素logistic回归模型分析各项临床指标与不良事件相关性,P<0.05为差异有统计学意义。
结果
1.一般临床资料:共纳入54例患者,其中早期肺癌10例,局部晚期肺癌44例。10例早期肺癌患者:中位年龄为59.5(53.5,66.7)岁,男性4例、女性6例;ⅠA期9例,ⅠB期1例,T1a期、T1b期、T1c期、T2a期分别为2、3、4、1例;初始治疗9例,局部放疗后复发1例;病理类型中腺癌7例、鳞状细胞癌3例;吸烟2例;肿瘤位于上叶4例、下叶6例;照射中位剂量为60(60,68.8)Gy(RBE)分3~12次,CTV中位体积为36.2(32.25,83.10)ml。
44例局部晚期肺癌患者的中位年龄为63(56.3,67.0)岁,其中32例(73%)患者采用同步化疗。放疗后,20例(45%)患者接受序贯化疗,14例(32%)患者接受免疫维持治疗,3例(7%)患者治疗后病情进展采用了靶向药物治疗。原发肿瘤病灶GTV照射中位体积为215.4(122.1,399.9)ml,照射中位剂量为72(65.0,76.0)Gy(RBE);因采用选择野照射,阳性淋巴结及预防性淋巴结引流区CTV中位体积为425.4(290.3,555.2)ml,照射剂量为48Gy(RBE)[5-7]。其他一般资料见表1。
2.不良反应及影响因素分析:所有患者均按计划完成了碳离子治疗计划,没有因为出现严重的不良反应而中断治疗。10例早期肺癌患者只照射了原发病灶,出现2例1级放射性肺炎,1例2级放射性肺炎、1例胸壁损伤(胸壁疼痛),没有2级以上的不良反应。44例局部晚期肺癌患者采用选择野照射,治疗靶区包含原发病灶以及预防性照射纵隔淋巴结引流区,出现2例(5%)1级皮肤反应、9例(20%)放射性食管炎(1、2级各6、3例)、14例(32%)不同程度的放射性肺炎(1、2、3级各7、5、2例),1例(2%)胸壁损伤,未发现4级不良反应。
采用逐步logistic回归多因素分析局部晚期肺癌≥2级不良反应的危险因素,未发现有统计学意义的变量(P<0.05);若将P值放宽到0.1,GTV≥215ml(OR=2.06,95%CI为0.39~30.41,P=0.068)可能是发生≥2级放射性肺炎的独立危险因素(表2)。

3.患者预后及影响因素分析:10例早期肺癌患者中位随访时间为11.0(6.75,17.25)个月。至最后一次随访,10例患者:3例完全缓解,3例部分缓解;
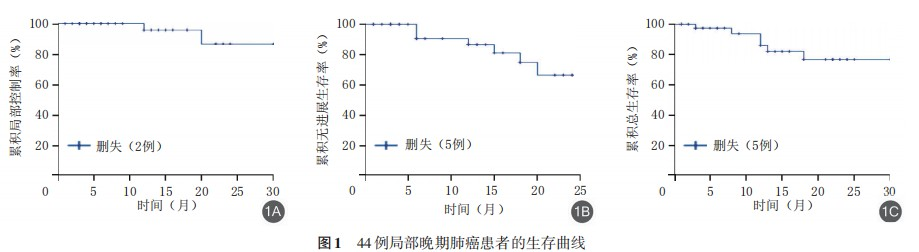
4例病情稳定,没有患者出现病情进展;1、2年LCR、PFS率、OS率均为100%。44例局部晚期患者中位随访时间为12.5(4.25,21.75)个月,至末次随访,3例(7%)完全缓解,17例(39%)部分缓解,19例(43%)病情稳定,5例(11%)病情进展。1、2年LCR分别为96.0%(95%CI为88.4%~103.6%)、87.3%(95%CI为69.5%~105.1%);1、2年PFS率分别为90.9%(95%CI为74.4%~99.0%)、84.1%(95%CI为44.2%~89.2%);1、2年OS率分别为93.2%(95%CI为73.9%~98.9%)、86.4%(95%CI为60.8%~93.8%);患者中位OS、PFS尚未达到,见图1。
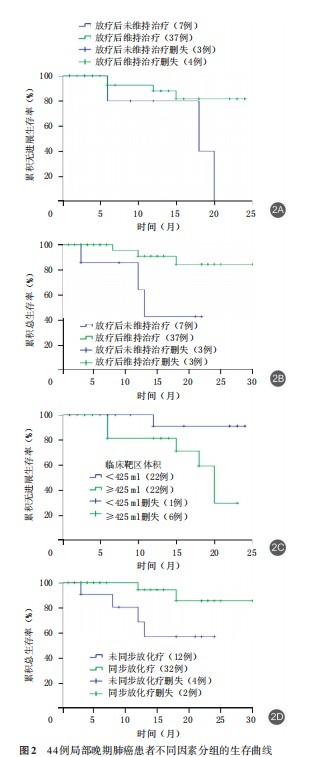
对44例局部晚期肺癌患者进行多因素分析,以确定不同分组中PFS和OS的潜在预后因素,结果提示:放疗后维持治疗(P=0.027)、CTV体积(P=0.028)是PFS的影响因素;同步放化疗(P=0.042)、放疗后维持治疗(P=0.020)是OS的影响因素。放疗后维持治疗患者的PFS期、OS期均长于放疗后未接受维持治疗的患者,PFS期为21.55(95%CI为19.33~23.76)∶16.40(95%CI为10.66~22.15)个月、OS期为27.40(95%CI为24.66~30.14)∶15.21(95%CI为9.77~20.66)个月(图2A、2B)。CTV照射体积<425ml患者的PFS期为22.91(95%CI为20.87~24.95)个月,长于CTV照射体积≥425ml患者的17.52(95%CI为14.26~20.78)个月(图2C);采用同步放化疗患者的OS期为27.97(95%CI为25.34~30.60)个月,长于未采用同步化疗患者的17.82(95%CI为13.02~22.62)个月(图2D)。
讨 论
带电粒子治疗被公认为肿瘤学领域的前沿技术,虽然比X射线更有效,但是在美国、欧洲和亚洲使用最多的仍是质子,只有少数中心采用重离子。1994年以来,日本NIRS一直在用高能碳离子治疗肿瘤[8]。截至2022年,世界范围内已经有46800例患者接受了重离子治疗(数据来自国际粒子治疗协作组网站)。
Miyamoto等[9]的Ⅰ-Ⅱ期前瞻性碳离子放疗研究中,Ⅰ期NSCLC T1期肿瘤患者的固定剂量为52.8Gy(RBE),T2期患者的剂量为60Gy(RBE),每周4次,总体5年LCR为90%。Saitoh等[10]的碳离子大分割治疗周围型Ⅰ期NSCLC前瞻性Ⅱ期研究(GUNMA0701)中,37例患者采用碳离子大分割治疗,2、5年LCR分别为91.2%、88.1%,2、5年总生存率为91.9%、74.9%,2例伴基础肺疾病患者出现≥2级的肺不良反应,1例无基础肺疾病患者出现<2级不良反应。一项采用体部立体定向放疗治疗NSCLC T1N0M0期的多中心前瞻性研究对于可手术和不可手术人群的3年总体存活率分别为76.5%和59.9%。然而,重症肺不良反应发生率较高[11]。RTOG 0236在美国进行的临床试验采用了60Gy分3次的光子治疗方案,结果显示3-4级肺不良反应发生率为16%[12]。
本研究的10例早期肺癌均采用碳离子大分割治疗,根据肿瘤与危及器官的毗邻关系分别采用了50~76Gy(RBE)分3~12次的分割模式,2例患者发生1级放射性肺炎,1例患者发生2级放射性肺炎,1例患者出现胸壁疼痛,未出现其他不良反应。截止最后一次随访,10例患者中未出现局部复发及远处转移病例,LCR、PFS率、OS率均为100%。
局部晚期NSCLC患者治疗往往采用手术或放化疗。Bradley等[13]进行的RTOG 0617光子放化疗治疗Ⅲ期局部晚期NSCLC研究中,采用60Gy光子照射剂量联合同期化疗,患者的中位PFS期、中位OS期分别为11.8、28.7个月,2年PFS率、OS率分别为30.7%、57.6%。Yamamoto等[14]进行的光子Ⅲ期局部晚期NSCLC的放化疗多中心Ⅲ期临床试验,接受顺铂+紫杉醇放化疗患者的中位PFS期、中位OS期分别为9.5、22.0个月。Takahashi等[5]和Karube等[15]分别采用碳离子治疗Ⅱ-Ⅲ期局部晚期NSCLC的62例和64例患者,2年PFS率和OS率分别为42.3%和51.9%~62.2%。Hayashi等[4]的迄今为止最大样本量的研究,纳入144例局部晚期肺癌纯碳离子治疗患者,中位PFS期、中位OS期分别为11.6、29.3个月,2年PFS率和OS率分别为40.2%和58.7%。
本研究的44例局部晚期肺癌患者,截至最后一次随访中位PFS、OS尚未达到,1、2年PFS率分别为90.9%、84.1%,1、2年OS率分别为93.2%、86.4%,从数据看患者预后好于日本NIRS治疗的病例。CSCO及NCCN指南均将同步放化疗作为局部晚期NSCLC的标准治疗方案,本研究在治疗过程中也参照指南推荐意见,经过多学科会诊给予患者系统综合治疗,包括同步化疗以及治疗后的序贯化疗、免疫维持治疗,还有3例(7%)病情进展后采用靶向治疗。进一步分析影响患者预后的因素,发现放疗后维持治疗(P=0.027)、CTV体积(P=0.028)是PFS的影响因素,放疗后继续采用免疫治疗、序贯化疗的PFS期长于未继续治疗的患者,CTV体积<425ml患者的PFS期长于>425ml的患者,说明病灶范围越局限、照射范围越小则PFS更优。同步放化疗(P=0.042)、放疗后维持治疗(P=0.020)是OS的影响因素,治疗中采用了同步化疗以及治疗后继续综合治疗的患者OS期长于未接受同步化疗及维持治疗的患者。这进一步证实碳离子放疗联合化疗、免疫维持治疗较单纯碳离子治疗患者预后有显著改善,这也可能是本研究目前治疗数据优于日本NIRS的一个主要原因。
关于不良反应,10例早期肺癌患者未出现>3级的不良反应,但有1、2级的放射性肺炎的发生。44例局部晚期肺癌患者采用选择野照射,发生1、2级放射性食管炎的患者分别为6例(13.6%)、3例(6.8%),无>3级的食管不良反应,发生1、2、3级放射性肺炎的患者分别为7例(15.9%)、5(11.4%)、2例(4.5%)。一些研究表明,使用光子放化疗≥3级的肺炎和食管炎概率分别为7%~11%和7%~20%[13-14,16]。Hayashi等[4]报道的144例局部晚期肺癌纯碳离子治疗的患者中,5例(3.5%)发生2级食管炎,未出现3级食管反应,发生2、3级放射性肺炎的患者分别为10例(7.1%)、5例(3.5%)。本研究表明:鉴于碳离子较光子优越的物理和生物学特性,即使采用选择野照射以及采用同步化疗、维持治疗,不良反应发生率也没有高于光子放化疗;而较单纯碳离子治疗,肺、食管不良反应并没有显著增加。进一步分析≥2级放射性肺炎、食管炎的危险因素,结果提示GTV体积≥215ml(OR=2.06,P=0.068)可能是发生2级以上放射性肺炎的独立危险因素,治疗前化疗、同步化疗、治疗后维持治疗、提高GTV剂量≥72Gy(RBE)等因素均未增加出现2级以上放射性肺炎、食管炎的风险。
本研究是国产碳离子治疗系统在甘肃省武威肿瘤医院重离子中心运行近3年来肺癌临床数据的首次报告。本研究的局限性:首先,本研究是单中心回顾性研究;其次,截至目前随访时间仍不够长,患者远期疗效仍需进一步观察;最后,因为重离子治疗费用昂贵,我们缺乏资金支持,加之患者的治疗意愿,在我中心开展Ⅲ期随机对照临床研究面临很大困难。但可喜的是目前国家在国内布局的多家重离子中心正在建设中,期待将来更多的中心能够开展高级别的临床研究来获得更多的临床证据。就目前我中心临床治疗结果来看,碳离子治疗早期以及局部晚期肺癌的临床效果确切、不良反应可控。此外,随着化疗、靶向治疗、免疫治疗等药物的发展,重离子治疗和这些药物的联合明显改善患者的预后而不良反应没有显著增加。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 潘鑫、张雁山:设计研究方案,研究实施及论文撰写;张一贺、叶延程:收集临床数据,提出研究思路,技术指导及论文修改;秦天燕、马彤:文献查找及数据分析;其他人参与研究
参考文献
[1] Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022,72(1):7-33. DOI: 10.3322/caac.21708.
[2] 郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. DOI: 10.3760/cma.j.issn.0253-3766.2019.01.005.
Zheng RS, Sun KX, Zhang SW, et al. Report of cancer epidemiology in China, 2015[J]. Chin J Oncol,2019,41(1):19-28. DOI: 10.3760/cma.j.issn.0253-3766.2019.01.005.
[3] Miyamoto T, Yamamoto N, Nishimura H, et al. Carbon ion radiotherapy for stage I non-small cell lung cancer[J]. Radiother Oncol, 2003, 66(2): 127-140. DOI: 10.1016/s0167-8140(02)00367-5.
[4] Hayashi K, Yamamoto N, Nakajima M, et al. Clinical outcomes of carbon-ion radiotherapy for locally advanced non-small-cell lung cancer[J]. Cancer Sci, 2019, 110(2):734-741. DOI: 10.1111/cas.13890.
[5] Takahashi W, Nakajima M, Yamamoto N, et al. A prospective nonrandomized phase I/II study of carbon ion radiotherapy in a favorable subset of locally advanced non-small cell lung cancer (NSCLC) [J]. Cancer, 2015,121(8):1321-1327. DOI: 10.1002/cncr.29195.
[6] Hayashi K, Yamamoto N, Karube M, et al. Prognostic analysis of radiation pneumonitis: carbon-ion radiotherapy in patients with locally advanced lung cancer[J]. Radiat Oncol, 2017, 12(1): 91. DOI: 10.1186/s13014-017-0830-z.
[7] 潘鑫, 张一贺, 李小军, 等. 两种剂量分割模式碳离子放射治疗肺癌淋巴引流区临床报告[J]. 中华放射肿瘤学杂志,2023, 32(3): 215-221. DOI: 10.3760/cma. j. cn113030-20220401-00119.
Pan X, Zhang YH, Li XJ, et al. Clinical report of two dose fractionation modes using carbon ion beam therapy in the lymph node drainage area for lung cancer[J]. Chin J Radiat Oncol, 2023, 32(3): 215-221. DOI: 10.3760/cma. j.cn113030-20220401-00119.
[8] Kamada T, Tsujii H, Blakely EA, et al. Carbon ion radiotherapy in Japan: an assessment of 20 years of clinical experience[J]. Lancet Oncol, 2015, 16(2):e93-e100. DOI: 10.1016/S1470-2045(14)70412-7.
[9] Miyamoto T, Baba M, Sugane T, et al. Carbon ion radiotherapy for stage I non-small cell lung cancer using a regimen of four fractions during 1 week[J]. J Thorac Oncol, 2007, 2(10): 916-926. DOI: 10.1097/JTO. 0b013e3181560a68.
[10] Saitoh JI, Shirai K, Mizukami T, et al. Hypofractionated carbon-ion radiotherapy for stage I peripheral nonsmall cell lung cancer (GUNMA0701): prospective phase II study[J]. Cancer Med, 2019, 8(15): 6644-6650. DOI:10.1002/cam4.2561.
[11] Nagata Y, Hiraoka M, Shibata T, et al. Prospective trial of stereotactic body radiation therapy for both operable and inoperable T1N0M0 non-small cell lung cancer: Japan clinical oncology group study JCOG0403[J]. Int J Radiat Oncol Biol Phys, 2015, 93(5): 989-996. DOI: 10.1016/j.ijrobp.2015.07.2278.
[12] Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J]. JAMA, 2010, 303(11): 1070-1076. DOI: 10.1001/jama.2010.261.
[13] Bradley JD, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study[J]. Lancet Oncol, 2015,16(2):187-199. DOI: 10.1016/S1470-2045(14)71207-0.
[14] Yamamoto N, Nakagawa K, Nishimura Y, et al. Phase III study comparing second- and third-generation regimens with concurrent thoracic radiotherapy in patients with unresectable stage III non-small-cell lung cancer: West Japan Thoracic Oncology Group WJTOG0105[J]. J Clin Oncol, 2010,28(23):3739‐3745. DOI: 10.1200/JCO.2009.24.5050.
[15] Karube M, Yamamoto N, Shioyama Y, et al. Carbon-ion radiotherapy for patients with advanced stage non-small-cell lung cancer at multicenters[J]. J Radiat Res,2017,58(5):761-764. DOI: 10.1093/jrr/rrx037.
[16] Schild SE, Stella PJ, Geyer SM, et al. Phase III trial comparing chemotherapy plus once-daily or twice-daily radiotherapy in stage III non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2002, 54(2): 370-378. DOI:10.1016/s0360-3016(02)02930-9.
