两种剂量分割模式碳离子放射治疗肺癌淋巴引流区临床报告
两种剂量分割模式碳离子放射治疗肺癌淋巴引流区临床报告
中华放射肿瘤学杂志 2023 年3 月第 32 卷第 3 期 Chin J Radiat Oncol, March 2023, Vol. 32, No. 3
潘鑫1 张一贺1 李小军1 马彤1 王馨1 杨钰玲1 柴鸿钰1 秦天燕2 吕彩霞2 李鹏庆2 叶延程1 张雁山1
1甘肃省武威肿瘤医院重离子中心放疗科,武威 733000;2甘肃省武威肿瘤医院肿瘤登记/随访中心,武威 733000
通信作者:张雁山,Email:13830510999@163.com
【摘要】 目的 比较采用相对生物效应(RBE)剂量 48 Gy,16次和 12次分割碳离子束照射局部晚期非小细胞肺癌(LA‐NSCLC)淋巴结引流区的不良反应、有效性及生存率。方法 收集2020年6月至2021年12月甘肃省武威肿瘤医院重离子中心收治的病理确诊为LA‐NSCLC的患者72例,简单随机法分为A组、B组各36例,分别给予A组48 Gy(RBE)分16次和B组48 Gy(RBE)分12次碳离子束选择野照射淋巴结引流区,观察其急慢性不良反应、有效性及生存率。采用 Kaplan‐Meier 法绘制生存曲线,log‐rank 法进行差异检验。结果 A、B 组中位随访时间分别为 13.9(8.8~15.7)、14.6(6.3~15.9)个月,治疗有效分别为16例(44.4%)、9例(25.0%),疾病控制分别为34例(94.4%)、30例(83.3%)。统计分析显示A、B组总生存率的差异无统计学意义(χ2=1.192,P=0.275)。两组患者放疗计划参数比较显示,CTV 体积,患侧肺 Dmean、V5 Gy(RBE)、V20 Gy(RBE)、V30 Gy(RBE),心脏 V20 Gy(RBE)、V30 Gy(RBE)、Dmean,食管 V30 Gy(RBE)、V50 Gy(RBE)、Dmax、Dmean,气管 Dmax,脊髓 Dmax等相关指标的差异均无统计学意义(P值均>0.05)。纳入患者在治疗期间及随访过程中均未出现3、4级不良反应;两组患者1、2级急性放射性皮肤反应(χ2=5.134,P=0.077)、放射性食管炎(χ2=1.984,P=0.371)、晚期放射性肺炎(χ2=6.185,P=0.103)发生情况的差异均无统计学意义。结论 碳离子放疗系统两种剂量分割模式在LA‐NSCLC纵隔淋巴结引流区选择野照射治疗中安全性相近,不良反应可控,远期疗效仍需进一步观察。
【关键词】 放射疗法,碳离子; 癌,非小细胞肺; 选择性淋巴结引流区放疗; 不良反应; 近期疗效
基金项目:甘肃省科技重点研发计划‐社会发展类 重离子治疗中心项目建设(19YF3FH001);甘肃省自然科学基金‐2021年甘肃省科技厅创新基地和人才计划项目(21JR7RH896)
目前全世界范围内,肺癌的发病率和死亡率均居高不下,肺癌患者预后差的主要原因之一是发现时病期已晚,丧失手术机会。Ⅰ期非小细胞肺癌(non‐small cell lung cancer,NSCLC)患者行手术治疗后,可达92%的10年生存率[1]。因此早期发现肺癌,并对其进行合理分期,选择合适的治疗方案,对改善患者预后有着重大意义。
Verhagen 等[2]报道Ⅰ期 NSCLC 患者即使接受根治性手术,术后复发率仍为25%~50%,淋巴结转移是术后复发的主要因素之一。纵观肺癌的外科治疗,肺叶切除并淋巴结清扫是标准推荐方案。如2020年美国国立综合癌症网指南及中国临床肿瘤学会 2020 指南,即便对于 T1期肺癌都是推荐肺门纵隔淋巴结清扫术的。在 CT 用于放疗定位之前,选择性淋巴结引流区照射(elective node radiation,ENI)一直是 NSCLC 放疗的标准治疗模式,其优点在于可以减少区域淋巴结的放疗失败率[3]。由于ENI的照射范围包括原发肿瘤、转移淋巴结和临床阴性淋巴结引流区,使过多的正常肺、食管和心脏等重要器官包括在照射野内,因此,易发生放射性肺炎、食管炎等严重并发症,使原发肿瘤的照射剂量反而难以有效提高,而碳离子束物理学和生物学方面的诸多优势,使得ENI成为可能。
本研究使用碳离子治疗系统治疗局部晚期非小细胞肺癌(locally advanced non ‐ small cell lung cancer,LA‐NSCLC),分别给予其淋巴结引流区相对生物效应(relative biological effect,RBE)为 48 Gy(RBE)分 16 次分割和 48 Gy(RBE)分 12 次分割碳离子束照射,观察急慢性不良反应、有效性及生存率,以便为 LA‐NSCLC碳离子放疗计划的制订与优化提供参考依据。
资料与方法
1. 患者资料:选取 2020 年 6 月至 2021 年 12 月甘肃省武威肿瘤医院重离子中心收治的72例病理学确诊的LA‐NSCLC患者,分别采用头颅MR、胸部CT 和 PET‐CT,按照美国癌症研究联合会第 8 版分期标准进行分期,将T1‐3N1‐2M0期、T3‐4N0‐1M0期的纳入患者随机分为 A、B 两组,每组各 36 例患者。本研究经甘肃省武威肿瘤医院伦理委员会审批通过(2021‐伦理审查‐05)。
2.碳离子治疗
(1)患者治疗采用仰卧位,平躺于定位床上,头下垫固定枕头,双手上举交叉至头顶,双肘尽量平伸,使用胸部热塑体罩和真空垫固定体位。CT 扫描为平扫和增强两种序列,并进行4DCT扫描,层厚和层距均为 3 mm,扫描部位从患者的环甲膜到第一腰椎下缘。
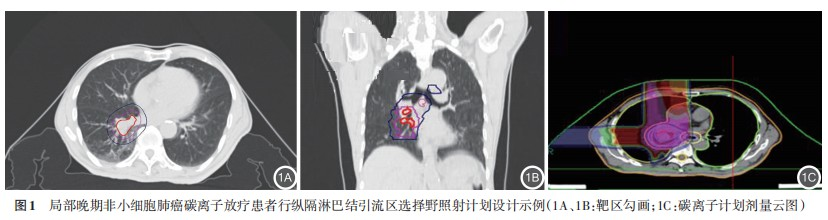
(2)靶区勾画:采用统一标准勾画靶区(必要时需融合MR或PET‐CT)。GTV为影像学可见大体肿瘤体积(参考增强 CT、MRI 或 PET‐CT);GTVnd为纵隔转移淋巴结,其定义为短轴直径≥1 cm和/或PET‐CT 扫描阳性者和/或内镜超声等病理学诊断阳性者。CTV 为 GTV+GTVnd外 0.5 cm 及预防性淋巴结引流区(转移淋巴结累及野+根据淋巴结转移的风险度进行预防照射的范围,一般为Ⅱ、Ⅳ、Ⅴ、Ⅶ组淋巴结区域);ITV 为 4DCT 可见的 CTV 移动范围;PTV为ITV外放3~5 mm,危及器官处适当调整。碳离子治疗计划使用 Ci‐Plan 碳离子治疗计划系统(1.0 版本)制订。处方剂量:A 组淋巴结引流区照射剂量为 48 Gy(RBE)分 16 次分割,B 组剂量为 48 Gy(RBE)分 12 次分割,两组患者肿瘤原发病灶总剂量为72 Gy(RBE)。
3. 随访情况:随访采取门诊随访,随访时间半年以上,从放疗结束后第 1 日开始。前 2 次每月来院复查,后每 3 个月随访 1 次,随访至 2022 年 2 月28日。
4.疗效评估及不良反应评价:对纳入的患者进行临床观察,急性期不良反应采用不良反应常见术语标准 V5.0 标准评价,晚期不良反应采用肿瘤放疗组织(Radiation Therapy Oncology Group,RTOG)标准评价。根据实体瘤疗效评价标准(RECIST 1.1)判定两种剂量分割方式患者疗效。局部控制率=(完全缓解+部分缓解+病情稳定)/可评价病例数×100%;复发时间(time to progression,TTP)定义为放疗开始至局部复发的时间,总生存(overall survival,OS)定义为放疗开始至任何原因死亡或最后一次随访的时间。
5.统计学处理:使用 SPSS 20.0软件进行统计、分析。计量数据使用 xˉ ± s 表示,占比使用百分比表示,采用 t检验、卡方检验分析计数资料,生存期使用 Kaplan‐Meier法进行分析,近期不良反应比较采用卡方检验。P<0.05为差异有统计学意义。
结 果
1. 一般资料:研究中共纳入 72 例经病理学确诊的 NSCLC 患者,A 组和 B 组的患者的男、女人数均为 26∶10(72.2%∶27.8%),年龄中位数分别为62.5(55~70)岁、62(51.5~68.5)岁。患者的病理类型中,A 组中鳞状细胞癌 17 例(47.2%)、腺癌 17 例(47.2%)占了大部分比例,B 组中鳞状细胞癌和腺癌分别为 17 例(47.2%)、15 例(41.7%)。根据中国临床肿瘤学会指南 NSCLC治疗原则及患者的实际病情,A组患者中有 22例(61.1%)采用同步化疗,B组中有31例(86.1%)患者采用了同步化疗,对比两组基本临床资料,患者卡诺夫斯凯计分(χ2=28.39,P<0.001)差异有统计学意义,其余指标的差异无统计学意义。患者一般资料见表1。
2. 治疗结果:按照研究设计,两组患者淋巴结引流区均给予了 48 Gy(RBE)的照射剂量,但分别采用了3 Gy(RBE)×16次、4 Gy(RBE)×12次的分割模式,计划设计如图1所示。为了解危及器官受量情况,我们将相关参数进行了统计学分析,结果提示患者照射的 GTV 体积,CTV 体积,患侧肺 Dmean、V5 Gy(RBE)、V20 Gy(RBE)、V30 Gy(RBE),心脏 V20 Gy(RBE)、V30 Gy(RBE)、Dmean,食管 V30 Gy(RBE)、V50 Gy(RBE)、Dmax、Dmean,气管 Dmax,脊髓 Dmax 等 相 关 指 标 的 差 异 均 无 统 计 学 意 义 ,见表2。
A 组和 B 组患者均按计划完成了处方剂量的碳离子治疗,所有患者在治疗期间及随访过程中均未出现3、4级的不良反应。从剂量学参数对比看,两组患者的危及器官参数无明显差异,但由于病情的不同,部分患者在碳离子治疗过程中采用了化疗。我们进一步对 2 组患者的早期及晚期不良反应进行了分析,结果显示两组患者1、2级急性放射性皮肤反应(χ2=5.134,P=0.077)、放射性食管炎(χ2=1.984,P=0.371)、晚期放射性肺炎(χ2=6.185,P=0.103)发生情况的差异均无统计学意义,见表 3。
3.患者预后
(1)两组患者近期疗效比较:本研究所有患者的随访时间截至 2022 年 2 月 28 日,所有纳入的患者均得到有效随访,并获得有效的随访数据,A 组中位随访时间为 13.9(8.8~15.7)个月,B 组中位随访时间为 14.6(6.3~15.9)个月,随访期间 A 组出现1 例(2.8%)野内复发,B 组出现 2 例(5.6%)野内复发,其余病情进展均为出现远处转移或新发转移病灶。其中:A 组治疗有效 16例(44.4%),B 组为 9例(25.0%),差异无统计学意义(χ2=3.003,P=0.083);A 组疾病控制 34例(94.4%),B组 30例(83.3%),差异无统计学意义(χ2=2.250,P=0.134)。
(2)两组患者生存状况比较:研究中通过Kaplan‐Meier 法绘制生存曲线图,分析两组患者随访期内的局部控制率及总生存情况,对生存状况进行比较。采用 log‐rank 法进行差异检验,分析显示B 组对比 A 组局部控制率(χ2=0.517,P=0.472)、总生存率(χ2=1.192,P=0.275)均接近,A、B 组平均LRFS 期分别为 20.8(95%CI 为 19.63~20.06)、17.1(95%CI 为 15.39~18.79)个月,A、B 组平均 OS 期分别为 21.1(95%CI 为 20.01~22.29)、16.8(95%CI 为15.27~18.42)个月,差异未见统计学意义(P>0.05),表明两组患者到随访截止总生存相近,见图2。
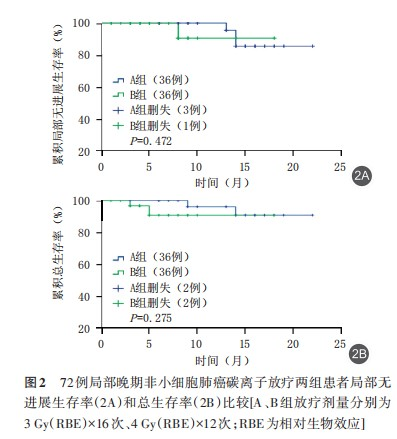
讨 论
区域淋巴结转移是 NSCLC 患者预后的一个主要因素,行肺切除术时,建议同时切除肺内淋巴结和纵隔淋巴结。尽管采用了预期的根治性治疗,但仍有25%~50%的早期肺癌患者在随访期间出现复发,提示疾病早期已出现孤立的肿瘤细胞的淋巴管播散和微转移影响患者预后[4]。
ENI的范围包括原发肿瘤、转移淋巴结和临床阴性淋巴结引流区,使得过多的正常肺、食管和心脏等重要器官包括在照射野内,因此,易发生放射性肺炎、食管炎等严重并发症,照射剂量也难有较大提高。有研究显示,NSCLC患者放疗后淋巴结引流区复发率为8%,而原发肿瘤区内的复发率高达65%[5]。因此,在原发病灶控制不理想的情况下,治疗靶区不必包含预防性 ENI,仅进行累及野治疗(involved‐field radiation,IFI)。传统的 LA‐NSCLC放疗靶区包括了淋巴结引流区,即ENI,如RTOG所开展的73‐01临床试验[6]。但是很多的研究结果表明,ENI并没有为患者带来局部控制率和生存率的获益[7]。鉴于传统的照射方式淋巴结引流区的复发率为8%,而原发肿瘤区内的复发率高达65%,因此,在原发病灶控制不理想的情况下,治疗靶区不必包含预防性ENI,即IFI。不做ENI可以显著降低PTV体积,在不增加治疗并发症的情况下可进一步提高原发肿瘤和转移淋巴结的照射剂量。
Li 等[8]2016 年的荟萃分析的结论也是 IFI 与ENI 对于 LA‐NSCLC 区域性淋巴结复发没有差异,且证据稳定而可靠。多项研究显示,LA‐NSCLC 对常规分割放疗具有高度抗性,同步放化疗后的局部区域失败率>60%[9]。从放射生物学角度来看,有相当多的理由支持使用重离子疗法改善这些患者的局部控制。在遇到目标组织时,带电重离子与物质的相互作用产生了目前可用的临床放射形式中最高的线性能量转移[10]。这将导致独特的双链DNA 损伤,产生较低的氧增强率和较高的相对生物有效性,其量级是光子放射治疗的3倍[10]。也正因为如此,使得患者在不良反应较少的前提下,不仅能保证原发灶的剂量达到 72 Gy(RBE)以上,也能保证引流区的剂量达到48~52 Gy(RBE),这可能引领肺癌临床放疗进入一个新的时代。
Saitoh等[11]对2013—2014年碳离子治疗的6例NSCLC 患者进行分析,给予患者肿瘤照射剂量 64 Gy(RBE)分 16 次,区域淋巴结引流区预防性剂量40 Gy(RBE)分 10 次,中位随访期 26 个月,1 年和2年的OS率分别为83%和50%,无进展生存率分别为 33% 和 33%。出现 1 例 2 级食管炎,1 例 2 级肺炎,没有大于3级不良反应。日本国立放射线医学综合研究所(National Institute of Radiological Science,NIRS)于 2000—2010 年共治疗 36 例肺癌淋巴结转移患者,给予48 Gy(RBE)分12次,3年OS和局部控制率分别为52.9%和100%,没有2级以上的早期和晚期不良反应。日本NIRS对于区域淋巴结引流区预防性照射中位剂量为 49.5 Gy(RBE)[12-13]。
基于上述的证据和理由,本研究在 LA‐NSCLC患者碳离子治疗中采用 ENI 照射纵隔淋巴结引流区,处方剂量为48 Gy(RBE),并给予原发肿瘤病灶推量24 Gy(RBE),这样原发病灶局部剂量达72 Gy(RBE)。
重离子治疗往往采用大分割模式,减少总治疗时间并获得了更高的生物学效应[14]。分析表明肿瘤生物有效剂量与整体存活率之间存在适度的线性关系,即生物有效剂量每增加 1 Gy,OS 率提高0.36%~0.7%[15]。因此我们在研究中设计了 48 Gy(RBE)分 16 次分割和 48 Gy(RBE)分 12 次分割两种模式观察患者疗效和不良反应。本研究中 A、B组中位随访时间为 13.9(8.8~15.7)、14.6(6.3~15.9)个月,治疗有效率分别为 44.4%、25.0%,差异无统计学意义(χ2=3.003,P=0.083),疾病控制率分别为94.4%、83.3%,差异无统计学意义(χ2=2.250,P=0.134),但两组患者在随访期内均出现了局部复发的情况。根据目前证据,局部晚期肺癌同步放化疗通常给予原发肿瘤/阳性淋巴结60 Gy的剂量,我们的研究中两组患者 ENI均接受了 48 Gy(RBE)碳离子照射剂量。那么是否存在阳性淋巴结局部剂量不足的问题?如果进一步给予阳性淋巴结局部推量是否可以进一步提高局部控制率?这都是我们所思考的问题。目前所有患者正处于随访中,我们将在下一步的工作中设计相关的研究来回答这些问题。与此同时,我们也分析了两组患者的整体预后情况,通过 Kaplan‐Meier 法绘制生存曲线图,结果提示 B组与 A 组总生存率(χ2=1.192,P=0.275)接近,究其原因可能是提高了单次分割剂量,但局部肿瘤总剂量并未有提升,此外也可能是目前随访时间不够长,远期临床观察数据我们将做后续报告。
NIRS在1995—2015年间一项回顾性研究分析了 141 例碳离子治疗 LA‐NSCLC 的临床数据,结果提示肿瘤推荐照射剂量 72 Gy(RBE)分 16次,对于有区域淋巴结转移的患者给予淋巴结引流区照射剂量 49.5 Gy(RBE)分 16 次,有 1 例(0.7%)患者出现了 4 级(纵隔出血)急性不良反应、5 例(3.5%)出现 3 级放射性肺炎、1 例(0.7%)出现 3 级支气管瘘[16]。本研究中两组患者在治疗及随访期间均未出现 3、4 级严重的不良反应,主要为 1、2 级的急性期皮肤反应和/或食管反应,大部分患者不需要药物或仅仅给予局部黏膜保护剂症状即可缓解。两组患者在发生不良反应方面及治疗计划危及器官参数比较中差异均无统计学意义,显示了对两种分割模式治疗的安全性和良好耐受性。
综上所述,碳离子治疗系统两种分割模式在LA‐NSCLC 纵隔淋巴引结流区选择野照射均显示了安全性及良好的耐受性,从短期的疗效对比二者之间并无明显差异,这也可能与随访时间短有关,远期随访数据我们将做后续报道。但就目前数据而言,采用较少的分割次数可缩短总治疗时间,从而提高碳离子治疗系统临床利用率,节约医疗资源,从这方面来讲对计划制订者可提供一定的参考价值。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 潘鑫、张雁山:设计研究方案,研究实施及论文撰写;张一贺、李小军、叶延程:收集临床数据,提出研究思路,技术指导及论文修改;秦天燕、马彤:文献查找及数据分析;其他人参与研究
参 考 文 献
[1] Takahashi W, Nakajima M, Yamamoto N, et al. A prospective nonrandomized phase I/II study of carbon ion radiotherapy in a favorable subset of locally advanced non-small cell lung cancer (NSCLC) [J]. Cancer, 2015,121(8):1321-1327. DOI: 10.1002/cncr.29195.
[2] Verhagen AF, Bulten J, Shirango H, et al. The clinical value of lymphatic micrometastases in patients with non-small cell lung cancer[J]. J Thorac Oncol, 2010,5(8):1201-1205. DOI: 10.1097/JTO.0b013e3181e29ace.
[3] Sulman EP, Komaki R, Klopp AH, et al. Exclusion of elective nodal irradiation is associated with minimalelective nodal failure in non-small cell lung cancer[J]. Radiat Oncol, 2009,4:5. DOI: 10.1186/1748-717X-4-5.
[4] Lee CB, Stinchcombe TE, Rosenman JG, et al. Therapeutic advances in local-regional therapy for stage III non-small-cell lung cancer: evolving role of dose-escalated conformal (3-dimensional) radiation therapy[J]. Clin Lung Cancer, 2006, 8(3): 195-202. DOI:10.3816/CLC.2006.n.047.
[5] Perez CA, Stanley K, Rubin P, et al. A prospective randomized study of various irradiation doses and fractionation schedules in the treatment of inoperable non-oat-cell carcinoma of the lung. Preliminary report by the Radiation Therapy Oncology Group[J]. Cancer, 1980,45(11):2744-2753. DOI: 10.1002/1097-0142(19800601)45:11<2744::aid-cncr2820451108>3.0.co;2-u.
[6] Emami B, Mirkovic N, Scott C, et al. The impact of regional nodal radiotherapy (dose/volume) on regional progression and survival in unresectable non-small cell lung cancer: an analysis of RTOG data[J]. Lung Cancer,2003, 41(2): 207-214. DOI: 10.1016/s0169-5002(03)00228-9.
[7] Machtay M, Paulus R, Moughan J, et al. Defining local-regional control and its importance in locally advanced non-small cell lung carcinoma[J]. J Thorac Oncol, 2012, 7(4): 716-722. DOI: 10.1097/JTO. 0b013e3182429682.
[8] Li RJ, Yu L, Lin SX, et al. Involved field radiotherapy (IFRT) versus elective nodal irradiation (ENI) for locally advanced non-small cell lung cancer: a meta-analysis of incidence of elective nodal failure (ENF) [J]. Radiat Oncol,2016,11(1):124. DOI: 10.1186/s13014-016-0698-3.
[9] Wang SL, Liao ZX, Wei X, et al. Analysis of clinical and dosimetric factors associated with treatment-related pneumonitis (TRP) in patients with non-small-cell lung cancer (NSCLC) treated with concurrent chemotherapy and three-dimensional conformal radiotherapy (3D-CRT)[J]. Int J Radiat Oncol Biol Phys, 2006, 66(5): 1399-1407. DOI: 10.1016/j.ijrobp.2006.07.1337.
[10] Durante M, Loeffler JS. Charged particles in radiation oncology[J]. Nat Rev Clin Oncol, 2010, 7(1): 37-43. DOI:10.1038/nrclinonc.2009.183.
[11] Saitoh JI, Shirai K, Abe T, et al. A phase I study of hypofractionated carbon-ion radiotherapy for stage III non-small cell lung cancer[J]. Anticancer Res, 2018,38(2):885-891. DOI: 10.21873/anticanres.12298.
[12] Takahashi W, Nakajima M, Yamamoto N, et al. A prospective nonrandomized phase I/II study of carbon ion radiotherapy in a favorable subset of locally advanced non-small cell lung cancer (NSCLC) [J]. Cancer, 2015,121(8):1321-1327. DOI: 10.1002/cncr.29195.
[13] Hayashi K, Yamamoto N, Karube M, et al. Prognostic analysis of radiation pneumonitis: carbon-ion radiotherapy in patients with locally advanced lung cancer[J]. Radiat Oncol, 2017, 12(1): 91. DOI: 10.1186/s13014-017-0830-z.
[14] Bradley JD, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study[J]. Lancet Oncol, 2015, 16(2): 187-199. DOI: 10.1016/S1470-2045(14)71207-0.
[15] Kaster TS, Yaremko B, Palma DA, et al. Radical-intent hypofractionated radiotherapy for locally advanced non-small-cell lung cancer: a systematic review of the literature[J]. Clin Lung Cancer, 2015, 16(2): 71-79. DOI:10.1016/j.cllc.2014.08.002.
[16] Hayashi K, Yamamoto N, Nakajima M, et al. Clinical outcomes of carbon-ion radiotherapy for locally advanced non-small-cell lung cancer[J]. Cancer Sci, 2019, 110(2):734-741. DOI: 10.1111/cas.13890.
