碳离子治疗局限期小细胞肺癌患者效果评价
碳离子治疗局限期小细胞肺癌患者效果评价
中华肿瘤防治杂志2024年7月第31卷第14期 CHIN J CANCER PREV TREAT, July 2024,Vol. 31 No.14
张一贺,张雁山※ ,叶延程,秦天燕,李万国,潘鑫,王馨,杨钰玲,马彤,冯利霞
甘肃省武威肿瘤医院(重离子中心放疗科:张一贺,张雁山,叶延程,潘鑫,王馨,杨钰玲,马彤;
肿瘤登记/随访中心:秦天燕;重离子中心放射技术室:李万国;
重离子中心放射物理室:冯利霞),甘肃 武威 733000
摘要:目的 观察局限期小细胞肺癌(LS-SCLC)碳离子治疗联合化疗和全脑预防性光子放疗(PCI)的安全性和有效性。
方法 选取2020-05-27-2023-04-13甘肃省武威肿瘤医院收治的经病理确诊的22例LS-SCLC患者为研究对象,碳离子处方剂量:72Gy(RBE)/12次。所有患者碳离子放疗同步使用EP方案化疗,碳离子治疗结束疗效评价达到完全缓解或部分缓解的患者给予PCI治疗,观察患者治疗前后神经元特异性烯醇化酶(NSE)水平、治疗相关毒性、1年和2年局部控制率、无进展生存率、总生存率。结果22例患者中21例患者完成了同步放化疗,1例患者因心肾综合征病史,肾功能分级3级未能接受化疗,其余患者耐受性良好。22例患者治疗前后NSE平均水平分别为(30.73±13.27)和(9.56±3.94)ng/mL,差异有统计学意义,t=7.168,P<0.001。随访5~35个月,1例患者拒绝PCI,在治疗后10个月出现多发性颅脑转移。1年和2年局部控制率分别为100.00%和92.31%;1年和2年总生存率分别为94.12%和84.71%,1年和2年无进展生存率分别为94.74%和77.73%。与碳离子治疗相关的不良反应有放射性肺炎(1级9例,2级2例)、食管炎(1级4例)、皮肤反应(1级1例),均为1、2级急性不良反应。结论 使用碳离子治疗联合化疗和PCI治疗LS-SCLC患者安全可靠,不良反应可耐受,局部控制率和生存率较好,但仍需要更多样本和更长时间随访进一步评估。
关键词:碳离子治疗;局限期小细胞肺癌;安全性;同步放化疗;脑预防性照射
中图分类号:R734.2文献标识码:A文章编号:1673-5269(2024)14-0887-06
小细胞肺癌(small cell lung cancer, SCLC)占所有肺癌的15%,具有生长迅速、血管密度高、基因组不稳定、早期易转移扩散、TP53和RB1基因普遍失活等特点,极易出现局部进展和远处转移[1-2]。尽管初始治疗的缓解率可达到较高水平,但患者极易复发与转移,5年生存率较低[3]。经过系统治疗的局限期小细胞肺癌(limited-stage small cell lung cancer,LS-SCLC)患者生存期仅为1~3年[4]。根据NCCN2023第一版的LS-SCLC治疗原则,Ⅰ~Ⅱa期患者可选择手术切除加辅助全身性治疗,或立体定向消融放疗加辅助全身性治疗,或同步放化疗;Ⅱb~Ⅲc期患者根据体能情况可接受同步放化疗[5]。荟萃分析显示,与单纯化疗相比,LS-SCLC胸部放疗可使局部病灶缩小25%~30%,2年总生存率相应改善5%~7%[6]。CONVERT一项3期随机试验,在547例LS-SCLC患者中评估了加速分割与常规分割,两组中位总生存期(over all survival,OS)相似,但加速分割组患者4级中性粒细胞减少发生率更高[7]。质子联合碳离子治疗LS-SCLC患者2年OS、局部无进展生存率(local progression free survivalrate,LPFS)、无远处转移生存率(distant metastasis-free survival,DMFS)和无进展生存率分别为81.7%、66.7%、53.6%和41.2%,且未发生4~5级毒性反应,治疗安全有效[8-9]。然而,即使放疗的介入提高了LS-SCLC的总体生存率,但仍有大部分患者出现了复发。系统性分析结果显示,越高的生物有效剂量(biological effective dose,BED),中位OS越高,中位PFS也越好,局部控制率也越高[10]。本研究探讨碳离子治疗LS-SCLC的安全性和有效性,为其临床诊治提供参考。
1 对象与方法
1.1 病例选择及一般资料
选取2020-05-27-2023-04-13在甘肃省武威肿瘤医院重离子中心接受碳离子治疗的经病理确诊的22例SCLC患者,治疗前经胸部增强CT、正电子发射计算机断层显像(positron emission tomography-computed tomography,PET-CT)、颅脑增强磁共振成像(magnetic resonance imaging,MRI)诊断为LS-SCLC,KPS评分≥70分,体力活动状态评分(performance status,PS)≤2分。其中男4例,女18例;年龄41~77岁,平均年龄(62.09±2.15)岁,中位年龄62岁。纳入标准:美国癌症联合委员会(American Joint Committee on Cancer, AJCC)第8版分期为Ⅰ-Ⅲc期;年龄≥14岁;预计生存期≥6个月;可耐受碳离子治疗。排除标准:有严重或者可能影响放疗的合并症;既往接受过放疗且再次放疗的计划不能满足危及器官的限量者;可能影响放射靶区剂量并造成不良后果的金属或假体等植入物。研究经本院医学伦理委员会审批(2020-伦理审查-25),并在中国临床试验注册中心注册(ChiCTR2100052807),所有患者被告知和签署书面知情同意书。
1.2 照射方法
患者取仰卧或俯卧位,双手交叉置于头顶,左手在上,枕部垫枕,采用大真空垫加热塑膜双重固定。CT扫描层厚为3mm,分别行平扫及增强序列及4DCT扫描(西门子 SOMATOM-Definition AS),扫描后的CT图像传至"rtstation"计划系统进行靶区勾画。
靶区勾画:肿瘤靶区(gross tumor volume,GTV)包括身体检查可发现病灶、CT及PET-CT可见原发病灶及转移淋巴结。临床靶区(clinical tumor volume,CTV)包括GTV+淋巴引流区(同侧肺门、隆突下和纵隔)。内靶区(internal target volume,ITV):CTV+4DCT最大密度投影(maximum intensity projection,MIP)范围。计划靶区(planning tumor volume,PTV)1:ITV+0.5cm;PTV2:GTV+MIP范围+0.5cm。处方剂量给予PTV1:48Gy(RBE)/12次,4Gy(RBE)/次,PTV2:24Gy(RBE)/12次,2Gy(RBE)/次,采用同步推量(simultaneous integrated boost,SIB),每周治疗5次;要求95%的处方剂量覆盖90%的PTV。正常组织限量参考中华医师协会放射肿瘤学医师分会制定中国离子治疗指南(2020年版):脊髓Dmax<45Gy(RBE),心脏Dmax<72Gy(RBE),肺Dmean<14Gy(RBE)、V20Gy(RBE)<20%(单侧)、V5Gy(RBE)<40%(单侧),食管Dmax<60Gy(RBE)[11]。
计划制作:武威碳离子计划系统(ciPlan1.0)使用的RBE计算模型为混合束线性平方模型(mixed beam LQmodel,MBM-LQ),利用HSG细胞存活实验中获得的LQ模型参数,进而获得10%细胞存活水平下的RBE深度分布曲线,用于射程调制装置的设计及计划优化。为使得计划靶区接受均匀生物有效剂量照射,计划系统使用迭代优化算法得到碳离子照射中各Bragg峰的照射剂量权重,根据各Bragg峰的照射权重,可获得物理剂量分布。与日本MKM模型相同,武威ciPlan的RBE模型中:临床剂量=生物有效剂量×1.43,生物有效剂量=物理吸收剂量×RBE,在相同的临床剂量下,MKM和ciPlan物理吸收剂量的差异不大。计划通过后传输至ciTreat治疗控制系统(ciTreat V2.0),采用被动扫描或点扫描技术,根据患者肿瘤深度及计算结果选择碳离子束能量范围120~400MeV/u。
1.3其他治疗
碳离子治疗与化疗同步进行,化疗方案为EP:依托泊苷(齐鲁制药有限公司,生产批号AB1K3011)100mg/m²d1~d3,顺铂(齐鲁制药有限公司,生产批号EA4A3008B)75mg/m²,d1,每21天一个周期,推荐碳离子结束后继续化疗4个周期。碳离子治疗结束后进行疗效评价,根据实体肿瘤疗效评价标准1.1版,其中完全缓解(complete response,CR)和部分缓解(partial response,PR)患者行全脑预防性光子照射(prophylactic cranial irradiation,PCI),照射剂量为25Gy(RBE)/10次。
1.4观察指标
观察指标包括治疗相关毒性、1年和2年局部控制率、无进展生存期(progression-free survival,PFS)和OS。放疗毒性反应评价参照美国肿瘤放射治疗协助组织和欧洲癌症治疗研究组(radio therapy oncology group/european organization for research on treatment of cancer,RTOG/EORTC)放射损伤分级,根据放射治疗后人体不同部位出现的急性放射反应来进行评估,分为0~4级。1年和2年LC、PFS和OS从碳离子治疗开始,直到发生相关事件或末次随访。
检测患者治疗前后神经元特异性烯醇化酶(neuron specific enolase,NSE)水平,治疗前后分别抽取患者外周血4mL,使用使神经元异性烯醇化酶测定试剂盒(深圳市新产业生物医学工程股份有限公司,生产批号02323041)进行检测。
1.5随访
所有患者通过电话或微信方式随访,相关资料通过邮寄方式进行收集。治疗期间患者每周监测血常规、肝肾功能,治疗结束第1年每3个月复查1次,其间执行身体检查、血液常规与生化检测、肿瘤标志物、腹部超声及肺部CT,必要时安排颅脑MRI。第2~3年每6个月复查1次,第4~5年每12个月复查1次。末次随访时间2023-09-30。
1.6统计学方法
采用SPSS22.0对数据进行统计分析,计量资料采用X-±S表示,两组间比较采用 t 检验;计数资料采用率或构成比表示。总生存率和无进展生存率采用Kaplan-Meier统计。检验水准α=0.05(双尾)。
2 结果
2.1安全性
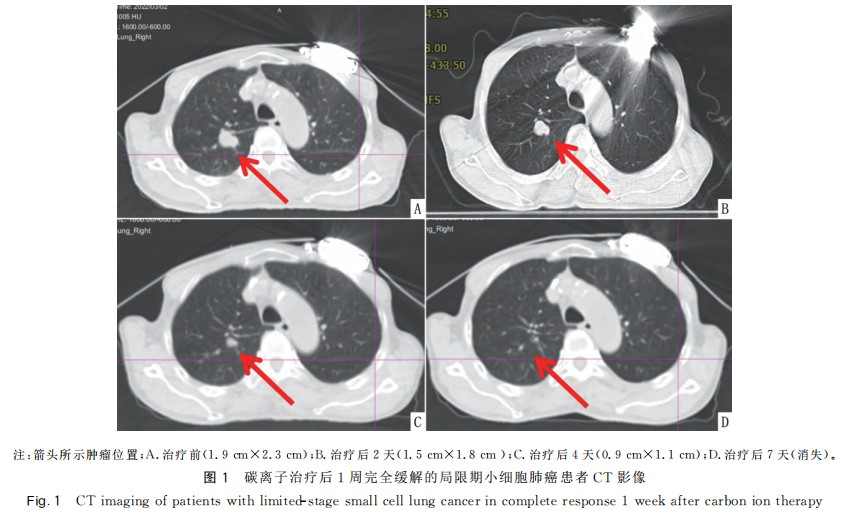
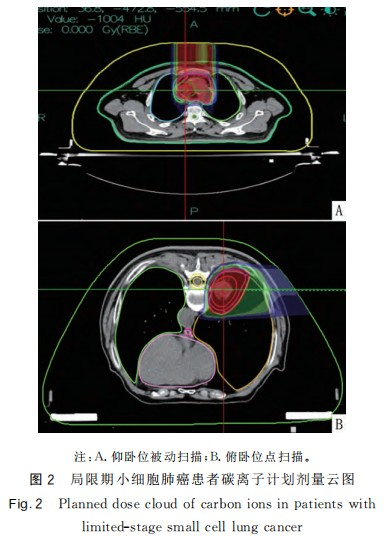
碳离子治疗结束后CR7例、PR15例。CR患者影像见图1。22例患者中仅1例患者因扩张性心肌病合并肾病综合征,经多学科会诊后不建议化疗,单纯行碳离子治疗和PCI。其余21例患者均按计划完成碳离子治疗及同步EP方案化疗,放化疗期间患者毒副作用可耐受。双肺、心脏Dmean均<11Gy(RBE),双肺V5、V20、V30分别<48%、26%、14%。心脏Dmax<71Gy(RBE)、V30<16%、V40<11%、V50<9%。食管Dmax<53Gy(RBE);脊髓Dmax<9Gy(RBE)。碳离子治疗计划危及器官受量见图2和表1。

2.2不良反应
21例患者放化疗耐受性良好,全部完成了至少2个周期的同步放化疗。其中发生皮肤反应1例(1级),肺炎11例(1级9例,2级2例),食管炎4例(1级),白细胞减少8例(1级5例,2级2例,3级1例),中性粒细胞减少6例(1级4例,2级1例,3级1例),血小板减少2例(1级),贫血3例(1级)。与碳离子治疗相关的不良反应有放射性肺炎(1级9例,2级2例)、食管炎(1级4例)、皮肤反应(1级1例),均为1、2级急性不良反应。
2.3有效性
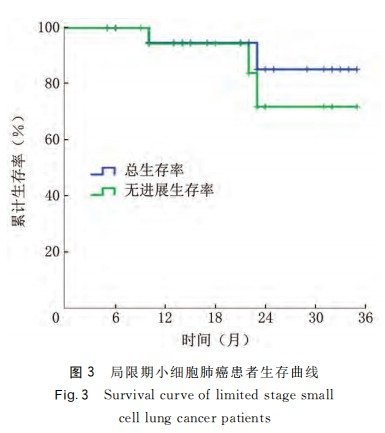
22例LS-SCLC患者治疗前后NSE平均水平分别为(30.73±13.27)和(9.56±3.94)ng/mL,差异有统计学意义,t=7.168,P<0.001。随访5~35个月,中位随访时间20个月,其中1例患者碳离子放疗后拒绝行PCI,至末次随访时无局部复发及远处转移,其余21例患者随访至1年均无局部复发及远处转移;随访至2年,1例患者治疗后16个月出现局部复发,1例患者治疗后23个月出现骨转移。使用Kaplan-Meier进行分析,22例患者1年和2年局部控制率分别为100.00%和92.31%;6、12、18和24个月无进展生存率分别为100.00%、94.74%、94.74%和77.73%;6、12、18和24个月总生存率分别为100%、94.12%、94.12%和84.71%。见图3。
讨论
胸部放疗是LS-SCLC治疗的重要组成部分,Morimoto等[12]研究表明,从任何治疗开始到胸部放疗结束的时间(the time from the start of any treatment to the end of chest irradiation,SER)是影响LS-SCLC生存的最重要因素,如果SER<30d,5年生存率将超过20%。一篇系统性综述报道认为局部复发(localrelapse,LR)是与LS-SCLC生存相关的主要因素,而BED每增加10Gy(RBE)可以使局部复发率降低5.5%,表明接受高BED治疗的患者可以降低局部失败率,从而提高OS[13]。由此可见,为提高LS-SCLC患者的生存获益和局部控制率,应该尽早开始放疗并在较短的时间内给予较高的照射剂量。
碳离子束属高线性能量转移(high linear energy transfer,LET),射线穿过物质时在浅层部位形成低剂量平坦区,而在射程末端时离子速度瞬间变得很低,残余能量完全释放,从而形成一个高电离密度的峰,即Bragg峰[14]。通过能量的调节使Bragg峰位达到肿瘤区的高剂量分布,达到对肿瘤的最大杀伤,对附近正常组织则不造成影响[15]。由于其独特的物理学特性,碳离子射束中心后缘在距95%等剂量线5mm处,剂量可跌落至处方剂量的20%~30%左右,因此肿瘤靠近危及器官的患者也可以进行安全的放疗[16]。本研究中纳入的22例LS-SCLC患者均选择碳离子治疗,并且同步行化疗,利用碳离子的物理和生物学优势,即便给予患者72Gy(RBE)/12次治疗剂量,患者危及器官受量均在限制范围内,治疗期间患者仅发生了1、2级碳离子治疗相关食管炎、肺炎和皮炎,给予对症治疗后缓解。后期随访至2年时,2例患者仍有间断性干咳,考虑为1级晚期放射性肺炎,没有2级及以上的晚期不良反应发生。所有患者在碳离子治疗期间及治疗后2年随访中无影响正常生活的碳离子治疗相关反应发生,患者耐受性和舒适度良好。
放疗相关不良反应的发生率与危及器官辐照剂量相关。有研究表明,肺癌患者接受光子放疗联合化疗后≥3级肺炎和食管炎发生率为分别为4.1%~10%和7%~14%[17-19]。一项有关乳腺癌患者在胸部放疗后的长期随访中发现,冠状动脉事件发生率与心脏Dmean≥10Gy(RBE)或更高剂量显著相关[18]。Shirai等[19]研究食管癌放化疗后胸腔积液发生的剂量因素分析中提出,心脏V50是胸腔积液发生的最强预测因子,心脏V50<20%、20%≤心脏V50<40%和心脏V50≥40%胸腔积液发生率分别为6%、44%和64%。Tonison等[20]关于调强适形放疗(IMRT)治疗食管癌后发生放射性肺炎的回顾性分析显示,肺V20被认为是放射性肺炎发生的危险因素,肺V20<23%可以将放射性肺炎发生率控制在10%以内。Watkins等[21]发现,食管V15是接受45Gy(RBE)/30次超分割放疗同步化疗的患者发生3级食管炎的相关因素,V15<60%,3级食管炎发生率为15%;V15≥60%,3级食管炎发生率高达64%。本研究中患者心脏Dmean<8Gy(RBE),D2<49Gy(RBE),V50<9%;双肺Dmean<10Gy(RBE),V20<26%,V30<14%;食管Dmean<53Gy(RBE),V15<43%;脊髓Dmax<9Gy(RBE)。本研究结果显示,使用碳离子治疗LS-SCLC,联合化疗和PCI治疗相关不良反应轻,治疗过程中有1例患者出现3级急性血液毒性,考虑为同步化疗药物引起,给予对症治疗后恢复正常,未影响下一周期化疗。
INT0096研究中,SCLC推荐的标准光子放疗治疗方案为45Gy(RBE)/1.5Gy(RBE)/2次联合EP方案同步化疗,1年总生存率为78%,局部复发率为36%[22]。尤静等[23]对26例LS-SCLC患者使用IMRT同步增量的照射方式,1年总生存率、无进展生存率分别为89%和51%。有研究显示,立体定向消融放疗(stereotactic ablative radiotherapy, SABR)剂量为50Gy(RBE)/5次,1年和3年局部控制率分别为97.4%和96.1%,1年和3年总生存率分别为69.9%和34%[24]。Mohamad等[25]试验中,30例LS-SCLC患者接受了45~66CGE/33~37次质子放疗,中位OS为28.2个月,1年和2年总生存率为72%和58%。
碳离子有其独特的生物学优势,可以造成约70%的DNA分子发生两处以上的双链断裂,难以被修复,导致肿瘤细胞的致死性损伤,且不依赖于细胞周期和氧环境的影响,有较高的相对生物效应[26-28]。本研究中接受碳离子治疗的22例患者在治疗结束时NSE均降至正常水平;其中1例因肾功能不全没有接受同步化疗的患者,仅单纯碳离子治疗结束后1周内肿瘤即完全消失;1例患者因拒绝行PCI,在治疗后10个月出现颅脑转移,至末次随访时该患者无局部复发及远处转移。本研究结果显示,LS-SCLC患者1年局部控制率、无进展生存率、总生存率分别为100.00%、94.74%、94.12%;2年局部控制率、无进展生存率、总生存率分别为92.31%、77.73%、84.71%。由此可见,碳离子治疗LS-SCLC在提高靶区剂量的同时并没有增加危及器官的辐照剂量,即便同步联合化疗及PCI,患者耐受性及依从性依然良好,因此碳离子放疗联合化疗和PCI安全有效,有可能是LS-SCLC的一种可选的治疗方法。
本研究尚存在局限性,纳入病例数较少,随访时间不够长,需要更多的前瞻性研究和更长时间的随访观察进行研究报道。
利益冲突 无
参考文献
[1] 刁文雅,刘青,孟琳慧,等.超高龄小细胞肺癌合并慢性肾衰竭免疫治疗1例并文献复习[J].实用老年医学,2023,37(4):422-423.
[2] Ganti AK,Zhen W,Kessinger A.Limited-stage small-cell lung cancer:therapeutic options[J].Oncology(Williston Park),2007,21(3):303-312.
[3] Parisi S,Ferini G,Lillo S,et al.Stereotactic boost on residual disease after external-beam irradiation in clinical stage III non-small cell lung cancer:mature results of stereotactic body radiation therapy postradiation therapy(SBRT postRT)study[J].Radiol Med,2023,128(7):877-885.
[4] 徐美怡,罗佳伟,许瑞莲.EGFR外显子20插入突变型NSCLC治疗的研究进展[J].中国肺癌杂志,2023,26(2):151-157.
[5] National Comprehensive Cancer Network.The NCCN clinical practice guidelines in oncology,Small cell lung cancer(version 3.2022)[EB/OL].(2022-05-22)[2024-06-18].https://www.nccn.org/professionals/physician_gls/pdf/sclc.pdf.
[6] Warde P,Payne D.Does thoracic irradiation improve survival and local control in limited-stage small-cell carcinoma of the lung?A meta-analysis[J].J Clin Oncol,1992,19(5-6):146-146.
[7] Faivre-Finn C,Snee M,Ashcroft L,et al.Concurrent once-daily versus twice-daily chemoradiotherapy in patients with limited-stage small-cell lung cancer(CONVERT):an open-label,phase 3,randomised,superiority trial[J].Lancet Oncol,2017,18(8):1116-1125.
[8] Grønberg BH,Killingberg KT,Fløtten Ø,et al.High-dose versus standard-dose twice-daily thoracic radiotherapy for patients with limited stage small-cell lung cancer:an open-label,randomised,phase 2 trial[J].Lancet Oncol,2021,22(3):321-331.
[9] Ma NY,Chen J,Ming X,et al.Preliminary safety and efficacy of proton plus carbon-ion radiotherapy with concurrent chemotherapy in limited-stage small cell lung cancer[J].Front Oncol,2021,11:766822.
[10] Mori K,Mostafaei H,Sari Motlagh R,et al.Systemic therapies for metastatic hormone-sensitive prostate cancer:network meta-analysis[J].BJU Int,2022,129(4):423-433.
[11] Zhang Q,Kong L,Liu R,et al.Ion therapy guideline(Version 2020)[J].Precis Radiat Oncol,2021,5(2):73-83.
[12] Morimoto M,Okishio K,Akira M,et al.Duration of twice-daily thoracic radiotherapy and time from the start of any treatment to the end of chest irradiation as significant predictors of outcomes in limited-disease small-cell lung cancer[J/OL].Clin Lung Cancer,2017,18(2):e117-e127[2024-05-05].https://www.sciencedirect.com/science/article/pii/S1525730416302297.DOI:10.1016/j.cllc.2016.09.004.
[13] Zhu L,Zhang S,Xu X,et al.Increased biological effective dose of radiation correlates with prolonged survival of patients with limited-stage small cell lung cancer:a systematic review[J/OL].PLoS One,2016,11(5):e0156494[2024-05-05].https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0156494.DOI:10.1371/journal.pone.0156494.
[14] Malouff TD,Mahajan A,Krishnan S,et al.Carbon ion therapy:a modern review of an emerging technology[J].Front Oncol,2020,10:82.
[15] 张雁山,叶延程,张红.碳离子束放射治疗肿瘤的临床进展[J].科技促进发展,2020,16(1):18-33.
[16] 马霄云,张雁山,张梦灵,等.重离子放射治疗靶区边缘剂量跌落分析[J].肿瘤学杂志,2021,27(5):390-394.
[17] Segawa Y,Kiura K,Takigawa N,et al.Phase III trial comparing docetaxel and cisplatin combination chemotherapy with mitomycin,vindesine,and cisplatin combination chemotherapy with concurrent thoracic radiotherapy in locally advanced non-small-cell lung cancer:OLCSG0007[J].J Clin Oncol,2010,28(20):3299-3306.
[18] Struikmans H,Petoukhova A,Schreur JHM,et al.Is the risk of ischemic heart disease in women after radiotherapy for breast cancer nowadays still(linearly)associated with the mean heart dose?[J].Acta Oncol,2024,10(63):175-178.
[19] Shirai K,Tamaki Y,Kitamoto Y,et al.Dose-volume histogram parameters and clinical factors associated with pleural effusion after chemoradiotherapy in esophageal cancer patients[J].Int J Radiat Oncol Biol Phys,2011,80(4):1002-1007.
[20] Tonison JJ,Fischer SG,Viehrig M,et al.Radiation pneumonitis after intensity-modulated radiotherapy for esophageal cancer:Institutional data and a systematic review[J].Sci Rep,2019,9(1):2255.
[21] Watkins JM,Wahlquist A,Shirai K,et al.Factors associated with severe acute esophagitis from hyperfractionated radiotherapy with concurrent chemotherapy for limited-stage small-cell lung cancer[J].Int J Radiat Oncol Biol Phys,2009,74(4):1108-1113.
[22] Bogart JA,Waqar SN,Mix MD.Radiation and systemic therapy for limited-stage small-cell lung cancer[J].J Clin Oncol,2022,40(6):661-670.
[23] 尤静,于会明,宋马小薇,等.局限期小细胞肺癌同步推量调强放疗的Ⅰ期/Ⅱ期临床研究[J].中国肺癌杂志,2017,20(1):28-34.
[24] Verma V,Simone CB,Allen PK,et al.Multi-institutional experience of stereotactic ablative radiation therapy for stage ismall cell lung cancer[J].Int J Radiat Oncol Biol Phys,2017,97(2):362-371.
[25] Mohamad O,Sishc BJ,Saha J,et al.Carbon ion radiotherapy:a review of clinical experiences and preclinical research,with an emphasis on DNA damage/repair[J].Cancers(Basel),2017,9(6):66.
[26] 张金花.Wnt/β-catenin通路参与调控碳离子束克服静止期He-La细胞的辐射抗拒性[D].北京:中国科学院大学,2022.
[27] Friis I,Verkhovtsev AV,Solov'yov IA,et al.Lethal DNA damage caused by ion-induced shock waves in cells[J].Phys Rev E,2021,104(5-1):054408.
[28] 王江涛.重离子(12C6+)辐照对非小细胞肺癌免疫微环境的调控作用和机制研究[D].甘肃:兰州大学,2022.
