碳离子放疗远隔效应临床病例报道
碳离子放疗远隔效应临床病例报道
中华放射医学与防护杂志 2024年8月第44卷第8期 Chin J Radiol Med Prot, August 2024, Vol. 44, No. 8
秦天燕 张一贺 张雁山 叶延程 潘鑫 王馨 杨钰玲 马彤 吕彩霞 李鹏庆
甘肃省武威肿瘤医院放疗科, 武威 733000
通信作者: 张一贺,Email: sipen@ 163. com
基金项目: 甘肃省科技计划项目 (23JRRH006)
放射治疗是癌症局部治疗的主要手段之一,相关研究发现,放疗射线能够诱导产生特殊的免疫刺激效应,即远隔效应(abscopal effect,AE),具体是指针对肿瘤局部病灶照射时,照射靶区之外的病灶亦缩小。碳离子放射治疗(carbon ion radiotherapy,CIRT)是目前临床放射治疗的优选方法,相比于常规放疗,具有更多的优势,被认为具有激活肿瘤细胞更强免疫原性的潜力[1]。首先,从物理学方面来看,碳离子在深度上表现出一种特征能量分布,称为"布拉格"峰,在靠近靶点的组织中,有高水平的能量沉积;近端组织接收到的能量很少。其次,从生物学方面来看,碳离子具有较高的传能线密度(LET),具有比光子更高的相对生物学效应(relative biological effectiveness,RBE),生物学效应较光子放疗在峰区至少放大2~4倍[2-4]。因碳离子的物理学特性和生物学特性优势,被认为CIRT比常规放疗更能诱导强免疫反应[5]。相关研究也表明,远隔效应的机制被认为是局部放疗引发了人体免疫系统一系列变化[6]。对于碳离子放射治疗诱导产生远隔效应的临床和机制研究较少,大部分实验结果表明,碳离子放射治疗能够引发强烈的促免疫反应,诱发更明显的远隔效应[5]。本研究通过对武威碳离子治疗系统自正式投入临床治疗以来,发生的3例远隔效应典型病例情况进行汇总报告,为碳离子放射治疗产生远隔效应的临床研究提供参考。
一、病例
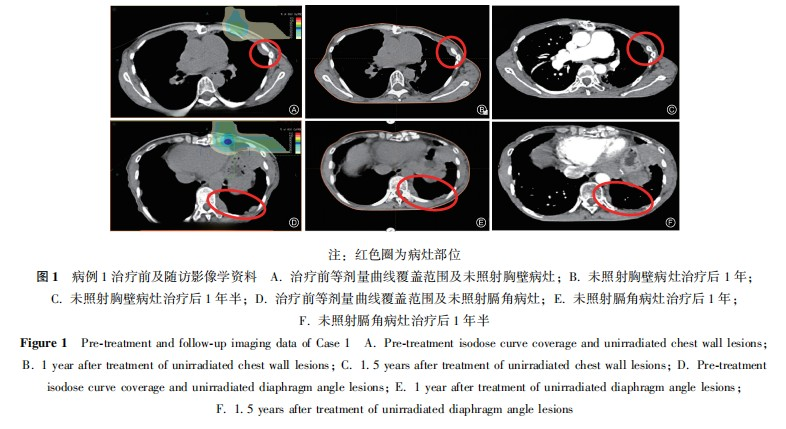
病例1:患者女性,48岁,主诉"恶性胸腺瘤术后10年,心慌、气短1年"就诊。患者于2009年2月16日行"胸腺肿瘤广泛切除术+左肺上叶、膈神经及心包部分切除术",术后病理显示:(前上纵隔)胸腺非角化型鳞状细胞癌。患者术后35d行术后调强放射治疗。DT:50Gy/25次,靶区范围包括原瘤床及上纵隔。此后,患者未接受任何治疗,定期行胸部CT随访。2019年12月患者再次出现心慌、气短症状,复查胸部CT提示:左侧胸膜、膈脚及腹膜多发结节,最大病灶位于左侧胸膜临近心包处,大小为6.3cm×5.2cm,左侧颈根部、纵隔、腹膜后内多发小淋巴结,考虑胸腺癌复发转移。患者临床诊断:胸腺癌复发转移,美国癌症联合委员会(AJCC)分期第8版T3N0M1aⅣA期。经多学科会诊(multidisciplinary treatment,MDT),考虑到患者上次手术及术后放疗后无病生存期较长,肿瘤表现为惰性生物学行为,仅对左侧胸膜临近心包处的最大肿瘤因压迫侵犯心脏进行姑息性碳离子放射治疗,用以缓解患者心慌、气短症状。制定治疗方案:对心脏左缘病灶行姑息性碳离子治疗,计划靶区(PTV)为60Gy(RBE)/12次,90%的PTV满足处方剂量。治疗期间仅出现治疗部位皮肤轻度色素沉着,根据常见不良事件评价标准5.0版(CTCAE-V5.0),诊断为放射性皮肤炎1级,治疗结束后2个月患者皮肤反应基本消失。治疗结束后当天进行胸部CT的复查,观察到不仅照射部位(心包左侧)的最大病灶出现缩小,其他受低剂量照射或未受照射的部位(左侧胸壁及左侧膈脚)的转移病灶也出现了不同程度的缩小,且在后续随访至1年的过程中持续缩小。治疗前、治疗结束时、治疗后1年患者心包左侧病灶最大径分别为6.3、4.6和3.9cm,左侧胸壁病灶最大径分别为2.8、1.9和0.8cm,左侧膈脚病灶最大径分别为4.1、3.9和3.4cm。参照实体瘤疗效评价标准(RECSIT)1.1实体瘤疗效评价标准:完全缓解(complete response,CR)是指所有靶病灶全部消失,淋巴结短轴<10mm,并至少持续4周以上;部分缓解(partial response,PR)是指所有靶病灶的最大长径总和减少30%以上,并至少持续4周以上;疾病进展(progression disease,PD)是指观察期间与最小值相比较最大长径的总和增加20%,或至少病灶增加5mm,或出现新的病灶;疾病稳定(stable disease,SD)是指既不能满足PR,又不能满足PD的病变,疗效评价为PR,图1。
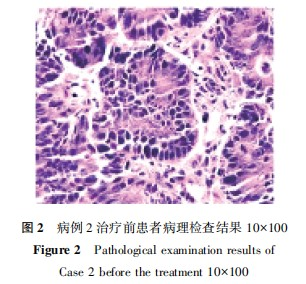
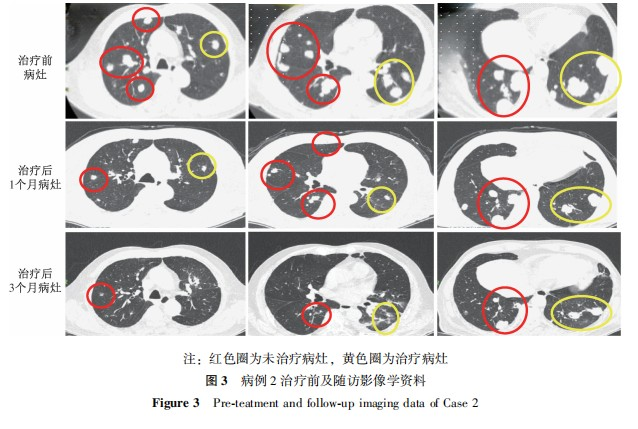
病例2:患者男性,81岁,主诉"结肠癌术后并多发肺转移6个月余"就诊。正电子发射计算机断层显像(PET)-CT显示:右半结肠部分切除术后,吻合口未见明显异常代谢;双肺多发不等大小结节,代谢增高,考虑转移;右侧额叶脑膜下不规则高密度结节,代谢低于脑实质,周围轻度水肿,脑膜瘤可能。胸部CT提示:两肺内多发结节肿块,部分空洞形成,结合病史,考虑转移瘤。向患者家属告知病情后行CT引导下肺穿刺活检术,术后病检显示,(肺穿刺组织)中分化腺癌,结合病史,多考虑结肠癌术后转移(图2)。患者临床诊断:肺继发恶性肿瘤,升结肠恶性肿瘤术后,AJCC分期第8版T3N0M1aⅣA期。经过多学科会诊,制定治疗方案,告知患者家属病情,患者及家属知情同意后行全身麻醉下高频振荡呼吸机管控状态下左肺部分转移病灶碳离子治疗,剂量为50Gy(RBE)/1次,治疗过程顺利。治疗后1个月、3个月和9个月复查提示,治疗病灶明显缩小,疗效评价:PR,未受照射的肺部其他转移病灶也出现了不同程度的缩小(图3)。
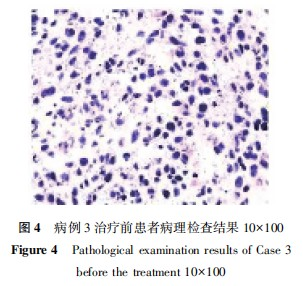
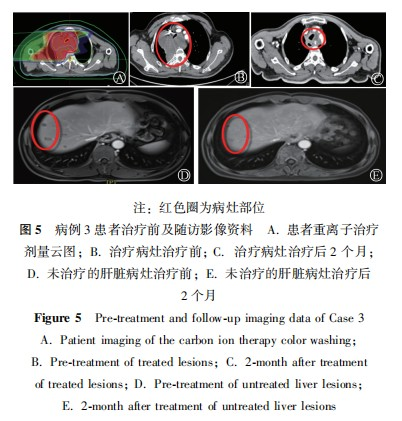
病例3:患者男性,53岁,主诉"进行性吞咽困难4个月,声音嘶哑1个月"就诊。胸部CT显示:食管癌根治术后,纵隔多发结节、肿块,部分融合,考虑转移。上腹部核磁共振(MR)显示:肝内多发结节影,病灶强化不典型,部分结节可疑晕环状强化,转移不除外。行超声引导下胸骨后方肿物穿刺活检术,病检显示:恶性肿瘤,结合免疫组化结果,倾向于间叶来源恶性肿瘤,免疫组化结果显示:CK5/6(-),CKp(-),Ki-67(index约50%),P40(-),P63(-),Vimentin(+),CR(-),HMB-45(-),S-100(-),SMA(灶状+),Desmin(-),CD117(-),DOG1(-)(图4)。患者临床诊断:纵隔恶性肿瘤(间叶组织来源);骨继发恶性肿瘤;淋巴结继发恶性肿瘤;肝继发恶性肿瘤;食管恶性肿瘤(术后);鳞状细胞癌。经过多学科会诊,制定治疗方案,告知患者家属病情,患者及家属知情同意后行纵隔部分肿物碳离子姑息性治疗,第1程剂量为30Gy(RBE)/10次,治疗结束后复查CT提示肿物明显缩小,气管压迫较前好转。修改靶区第2程计划剂量为18Gy(RBE)/6次。与家属沟通后给予左侧颈部转移淋巴结碳离子治疗,总剂量为52.8Gy(RBE)/12次,给予颈3椎体转移病灶碳离子治疗,总剂量为52.8Gy(RBE)/12次;给予肝脏S8段部分转移病灶碳离子治疗,总剂量为66Gy(RBE)/10次;给予右侧髂骨、腰5椎体转移病灶立体定向消融放疗(stereotacticablative radiotherapy,SABR)治疗,总剂量为20Gy/5次,治疗过程顺利。治疗后复查胸部CT和腹部MR,参照RECSIT1.1,疗效评价:PR。治疗后2个月,复查提示未经治疗的肝转移病灶在重离子治疗后2个月已消失(图5)。
二、讨论
1953年Mole对大鼠腹部照射实验中,首次提出了远隔效应的概念[5,7]。1975年报道的皮肤网状细胞肉瘤放射治疗时,发现非照射部位的转移瘤消退,此后相继有文献报道远隔效应现象[8-12]。远隔效应是指放射治疗期间,当给予肿瘤局部照射时,非照射靶区肿瘤病灶也缩小甚至消失[13]。相关研究报道其发生的机制可能为放射治疗可激活免疫系统,释放肿瘤的相关抗原,增加肿瘤组织环境的免疫原性,从而引起机体全身抗肿瘤的免疫应答,使得照射靶区之外的肿瘤受到一定程度的生长抑制[13-15]。当然,也有可能是局部放疗除了直接杀死肿瘤细胞外,还引起机体免疫细胞释放促炎因子,诱导照射靶区之外的肿瘤细胞染色体断裂或发生畸变,从而起到免疫介导肿瘤杀伤作用,使得照射靶区之外的肿瘤缩小或消失[13]。此外,影响远隔效应的发生发展还与放疗剂量、分割模式、免疫治疗类型、肿瘤类型有一定关联,尤其肿瘤免疫原性是远隔效应发生的重要因素[15-16]。
相关研究报道,质子、ɑ粒子以及碳离子放疗更能增强肿瘤免疫原性[15]。而碳离子放射治疗是临床放射治疗中最理想的肿瘤放射治疗技术,与常规的光子放射治疗相比,碳离子治疗能诱导更强的肿瘤免疫应答[1]。本研究中,胸腺癌患者在接受碳离子治疗1年后,未经照射的部位肿瘤发生了明显的缩小,胸腺是人体的免疫器官,加之碳离子具有较高的LET、比光子有更高RBE的物理学特性和生物学特性优势,更能诱导较强的免疫反应[2-4,17]。Demaria等[18]研究放射治疗引发AE的生物学机制中也提到,有免疫缺陷的小鼠不会发生远隔效应。另有研究也表明,远隔效应产生的机制被认为是局部放疗引发人体免疫系统一系列变化的表现[6]。故可以认为胸腺癌患者在接受碳离子照射后,胸腺免疫器官作为激发远隔效应的媒介,增强了对肿瘤细胞相关抗原呈递,提高了免疫系统对肿瘤的识别,从而更易诱发远隔效应的产生[19]。Sharab等[20]也报道大分割治疗以及高线性能量传递射线也能增加瘤相关抗原的抗原提呈和T细胞识别,从而更容易诱导远隔效应。而在本研究中,"结肠癌术后并多发肺转移"的患者,其左肺部分转移病灶给予50Gy(RBE)单次大剂量碳离子照射,在后期复查显示,治疗病灶疗效评价PR,未受照射的肺部其他病灶也出现了不同程度的缩小,即发生了远隔效应,这与Sharab等[20]报道的研究结果相一致。本研究观察病例中,胸腺癌患者和纵隔恶性肿瘤(间叶组织来源)的患者给予的都是多次中等辐射剂量照射,结肠癌术后并多发肺转移的患者给予的是单次大分割照射,3例患者均在治疗结束后3个月内出现了肿瘤缩小,且未经照射的肿瘤也出现缩小,产生了远隔效应,且在后期随访的过程中持续缩小,并在增强CT/PET-CT上可以明确地观察到,这与研究报道的较低辐射剂量(1.8~2.0Gy)不足以引发强免疫反应,中等辐射剂量(8~12Gy)能增强免疫反应并诱导强抗肿瘤作用,但更高辐射剂量(15~20Gy)可能会降低远隔效应的发生,大分割辐射能诱发强的免疫原性,从而易诱导远隔效应的产生的研究结论相一致[21]。
本研究观察的3例案例在治疗过程中未接受过免疫或其他药物治疗,其远隔效应的产生完全来自于碳离子,其发生的可能机制与现有的研究结论也基本一致。但本研究中涉及的样本例数较少,具体产生机制是否是因为碳离子独特的物理和生物学优势,还是因为免疫系统的特殊性,或是肿瘤本身对射线的敏感性以及碳离子治疗是否比光子更易诱发远隔效应的产生,是否可以通过联合免疫治疗来增强碳离子远隔效应的发生等,需要进一步探索研究。
综上所述,碳离子具有高LET、高RBE和复杂DNA损伤等优势,与常规的放射治疗相比,具有激活肿瘤细胞更强免疫原性的潜力[17],进一步探索碳离子诱发远隔效应的机制,为肿瘤的放射治疗寻找更有效的治疗具有重要意义。
利益冲突 无
作者贡献声明 秦天燕负责数据整理、分析与论文撰写;张一贺、潘鑫负责数据分析的指导;张雁山、叶延程负责论文写作的指导;王馨、杨钰玲、马彤、吕彩霞、李鹏庆负责数据收集工作
参 考 文 献
[1] Marcus D, Lieverse R, Klein C, et al. Charged particle and conventional radiotherapy: Current implications as partner for immunotherapy [J]. Cancers (Basel), 2021, 13(6):1468. DOI:10.3390/cancers13061468.
[2] 贾蓉, 苏锋涛, 胡步荣. 重离子的辐射生物效应及其在生命科学中的应用 [J]. 生物技术通报, 2018, 34(1):67-78. DOI:10.13560/j.cnki.biotech.bull.1985.2017-0735.
[3] Schmid TE, Multhoff G. Non-targeted effects of photon and particle irradiation and the interaction with the immune system [J]. Front Oncol, 2012, 2:80. DOI:10.3389/fonc.2012.00080.
[4] Keisari Y, Kelson I. The potentiation of anti-tumor immunity by tumor ablation with alpha particles, protons, or carbon ion radiation and its enforcement by combination with immunoadjuvants or inhibitors of immune suppressor cells and checkpoint molecules [J]. Cells, 2021, 10(2):228. DOI:10.3390/cells10020228.
[5] 高玉婷, 李媛, 金晓东. 碳离子辐射诱导的远隔效应 [J]. 生物化学与生物物理进展, 2023, 50(8):1915-1925. DOI:10.16476/j.pibb.2022.0371.
[6] Park B, Yee C, Lee KM. The effect of radiation on the immune response to cancers [J]. Int J Mol Sci, 2014, 15(1):927-943. DOI:10.3390/ijms15010927.
[7] Mole RH. Whole body irradiation: radiobiology or medicine? [J]. Br J Radiol, 1953, 26(305):234-241. DOI:10.1259/0007-1285-26-305-234.
[8] Matsubara S, Horiuchi J, Okuyama T, et al. A case of reticulu cell sarcoma of the skin showing abscopal effect during radiotherapy (author's transl) [J]. Nihon Igaku Hoshasen Gakkai Zasshi, 1975, 35(10):860-867.
[9] Togitani K, Asagiri T, Iguchi M, et al. Systemic abscopal effect of low-dose radiotherapy (2 Gy × 2) against palatine tonsil follicular lymphoma [J]. Intern Med, 2022, 61(20):3107-3110. DOI:10.2169/internalmedicine.8968-21.
[10] Sasaki H, Kato J, Horimoto K, et al. Delayed-onset abscopal effect after palliative radiotherapy for acral melanoma treated with anti-PD-1 therapy [J]. J Dermatol, 2022, 49(8):e255-e256. DOI:10.1111/1346-8138.16380.
[11] Zhang X, Zhang Y, Liu Y, et al. Stereotactic body radiotherapy-induced abscopal effect twice after pembrolizumab failure in hereditary leiomyomatosis and renal cell carcinoma: a case report with genetic and immunologic analysis [J]. Transl Androl Urol, 2021, 10(11):4304-4312. DOI:10.21037/tau-21-644.
[12] 丁心静, 卢致辉, 王芬, 等. 远隔效应在非小细胞肺癌免疫治疗时代的研究进展 [J]. 肿瘤预防与治疗, 2023, 36(5):432-439. DOI:10.3969/j.issn.1674-0904.2023.05.009.
[13] 张一贺, 张雁山, 李小军, 等. 碳离子治疗复发胸腺癌产生远隔效应临床观察1例 [J]. 中国肿瘤临床, 2021, 48(20):1075-1076. DOI:10.12354/j.issn.1000-8179.2021.20211145.
[14] 高怡凡, 孙晓蓉, 邢力刚. 放射免疫治疗中远隔效应的作用机制及临床应用 [J]. 中华肿瘤防治杂志, 2023, 30(14):881-886. DOI:10.16073/j.cnki.cjcpt.2023.14.09.
[15] 徐唐鹏, 胡梦雪, 许斌, 等. 远隔效应的作用机制及临床进展 [J]. 肿瘤学杂志, 2019, 25(3):202-205. DOI:10.11735/j.issn.1671-170X.2019.03.B005.
[16] Gorin JB, Ménager J, Gouard S, et al. Antitumor immunity induced after α irradiation [J]. Neoplasia, 2014, 16(4):319-328. DOI:10.1016/j.neo.2014.04.002.
[17] 高玉婷, 李鹏飞, 马国榕, 等. 辐射诱导远隔效应机制的研究进展 [J]. 中华放射肿瘤学杂志, 2023, 32(9):861-865. DOI:10.3760/cma.j.cn113030-20220822-00285.
[18] Demaria S, Ng B, Devitt ML, et al. Ionizing radiation inhibition of distant untreated tumors (abscopal effect) is immune mediated[J]. Int J Radiat Oncol Biol Phys, 2004, 58(3):862-870. DOI:10.1016/j.ijrobp.2003.09.012.
[19] 张惠博, 龚虹云, 刘华丽, 等. 远隔效应的研究进展与临床意义[J]. 肿瘤学杂志,2017,23(4):321-326. DOI:10.11735/j.issn.1671-170X.2017.04.B014.
[20] Sharabi AB, Nirschl CJ, Kochel CM, et al. Stereotactic radiation therapy augments antigen-specific PD-1-mediated antitumor immune responses via cross-presentation of tumor antigen [J]. Cancer Immunol Res, 2015, 3(4):345-355. DOI:10.1158/2326-6066.CIR-14-0196.
[21] Mortezaee K, Parwaie W, Motevaselei E, et al. Targets for improving tumor response to radiotherapy [J]. Int Immunopharmacol, 2019, 76:105847. DOI:10.1016/j.intimp.2019.105847.
