碳离子治疗复发胸腺癌产生远隔效应临床观察1例
碳离子治疗复发胸腺癌产生远隔效应临床观察1例
张一贺 张雁山 李小军 潘鑫
关键词 碳离子远隔效应 旁效应 胸腺癌doi:10.12354/j.issn.1000-8179.2021.20211145
患者女性,43岁,既往体健,否认吸烟及慢性肺病史。患者主因“胸腺癌术后放疗后10年,心慌、气短4个月”于2009年2月因心慌、气短就诊武威肿瘤医院,行胸部CT示:前上纵膈占位性病变,考虑胸腺肿瘤,考虑侵犯心包及左肺(图1A)。2009年2月16日行“胸腺肿瘤广泛切除术+左肺上叶、膈神经及心包部分切除术”,术后病理显示:(前上纵隔)胸腺非角化型鳞状细胞癌。肿瘤侵及心包及肺,未见大血管及淋巴结侵犯。病理诊断:Masaoka分期Ⅲa期,C型:胸腺癌。术后患者复查胸部CT提示:胸腺癌术后,左侧胸骨下三角形积液及心包前间隙积液,左侧胸膜广泛增厚、黏连并少量胸腔积液,胸骨术后局部骨质缺损,软组织肿胀(图1B)。术后诊断:pT3N0M0 Ⅲa期,依据为美国癌症联合委员会(AJCC) 第8版分期。患者术后35天行术后调强放射治疗DT:50 Gy/25 fx,靶区范围包括原瘤床及上纵隔。此后,患者未接受任何治疗,定期行胸部CT随访。2019年12月患者再次出现心慌、气短症状,复查胸部CT提示:左侧胸膜、膈脚及腹膜多发结节,最大病灶位于左侧胸膜临近心包处,大小为6.3 cm×5.2 cm,左侧颈根部、纵隔、腹膜后内多发小淋巴结,考虑胸腺癌复发转移。患者临床诊断:rcT2N2M1a Ⅳa期。经多学科会诊(multi-disciplinary treatment, MDT),考虑到患者上次手术及术后放疗后无病生存期较长,肿瘤表现为惰性生物学行为,仅对左侧胸膜临近心包处的最大肿瘤因压迫侵犯心脏进行姑息性碳离子放射治疗,用以缓解患者心慌、气短症状。选择碳离子治疗是因为碳离子具有独特的生物学和物理学优势。碳离子的生物学特性,具有更高的线性能量传递和更大的相对生物有效性(relative biological effect, RBE),及不受肿瘤细胞缺氧影响的低氧增强率(oxygen enhanced rate, OER),从而提高肿瘤的局控率。碳离子的物理特性,布拉格峰和小的横向散射,可以有更精准的辐射剂量分布[1]。因此,在给予肿瘤较高剂量的同时,可以最大限度的降低心脏和肺的照射剂量,从而保护危及器官。治疗方案:取俯卧位,双手交叉置于头顶,左手在上,额部垫枕,采用大真空垫、热塑膜双重固定,CT扫描层厚为3 mm,分别行平扫序列、增强序列及4D扫描序列,扫描后的CT 图像传至“rtStation”计划系统进行靶区勾画。靶区勾画:肿瘤靶区(gross tumor volume, GTV)包括影像学可见临近左侧心包处的最大肿瘤;临床靶区(clinical tumor volume, CTV)为GTV外扩5 mm;计划靶区(plan tumor volume, PTV)为CTV外扩5 mm;危及器官处做适当调整,为保护左心室,在左心室旁留出1 cm的安全边界。治疗计划:碳离子治疗计划采用Ci-plan规划软件。治疗计划要求:90%的PTV满足处方剂量。设1个左侧水平野+1个垂直野照射,病灶照射总剂量为60 GyE(图2),单次剂量4 GyE,治疗每日1次,每周5次(周一至周五),共12次(fx),治疗3周。碳离子的剂量以光子等效剂量(GyE)表示,GyE定义为物理剂量乘以碳离子的RBE,其中通常设定碳离子的RBE为3.0[2]治疗期间及治疗后患者均未接受任何其他治疗。治疗结束后患者心慌、气短症状均缓解。治疗期间仅出现治疗部位皮肤轻度色素沉着,根据急性放射损伤分级标准(radiation therapy oncology group, RTOG)为皮肤1级反应;根据常见不良事件评价标准5.0版(CTCAE-V5.0):放射性皮肤炎1级。放疗结束后2个月患者皮肤反应基本消失。治疗结束后当天进行胸部CT的复查,观察到不仅照射部位(心包左侧)的最大病灶出现缩小,其他受低剂量照射或未受照射的部位(左侧胸壁及左侧膈脚)的转移病灶也出现了不同程度的缩小,且在后续随访至1年的过程中持续缩小(图3A~3D),治疗前及治疗后1年患者心包左侧病灶最大径分别为6.3、4.6和3.9 cm,左侧胸壁病灶最大径分别为2.8 、1.9和0.8 cm,左侧膈脚病灶最大径分别为4.1、3.9和3.4 cm。参照RECSIT 1.1实体瘤疗效评价标准,疗效评价:部分缓解(partial response, PR)。由于碳离子独特的物理学优势,使心脏及肺部等危及器官的受量较低,更好的保护了正常组织,患者在整个治疗期间没有出现≥2级的急性放射性损伤,治疗方式安全有效。
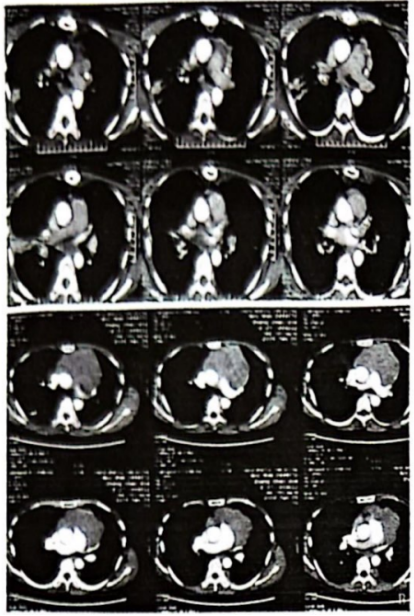
A:术前胸部增强 CT(2009年1月9日);B:术后胸部增强 CT(2009年2月21日)
图1 术前术后影像
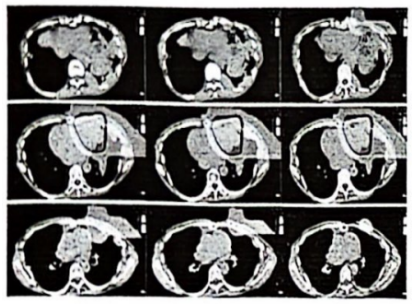
图2 射野方向及台计划剂盘云图(一个左侧水平野+一个垂直野)
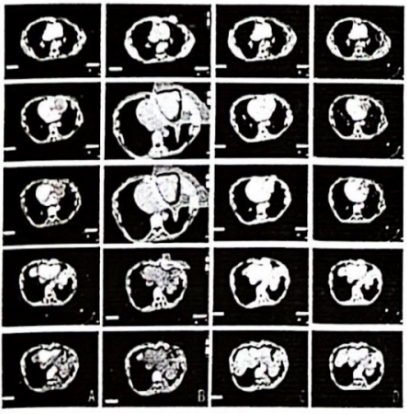
A:碳离子治疗前(2020年3月24日);B:1%~110% 的剂量云图:C:碳离子治疗后(2020年4月10日);D:碳离子治疗后1年(2021年4月 19日):红色-靶剂量照射区:绿色-低剂量照射区:紫色-米照射区
图3 胸部病灶治疗前后影像
小结
远隔效应是指当给予肿瘤靶区照射时引起非照射区域肿瘤缩小甚至消失地现象。其机制可能为局部放疗除了直接杀死肿瘤细胞外,还促进机体免疫细胞释放促炎因子,作用至非照射肿瘤位点,诱导非照射区肿瘤细胞染色体断裂或畸变,从而使肿瘤缩小或消失。当然,还可通过释放肿瘤的相关抗原、改变肿瘤的细胞表型,从而引起全身抗肿瘤的免疫应答,使得照射野外的肿瘤生长也受到一定程度的抑制。远隔效应的产生可能与放疗诱发产生肿瘤原位疫苗有关。原位疫苗效应即为通过放疗触发照射部位肿瘤相关获得性免疫应答及特异性抗原递呈反应的现象。Sharabi 等[3]报道单次大剂量的放疗可以增加肿瘤相关抗原的抗原提呈和T细胞识别,从而更容易诱导远隔效应。这可能与不同肿瘤对放射线的敏感度、放射线本身的特性、单次放射剂量以及是否联合其他治疗有关。远隔效应的产生已在多种肿瘤中得到了见证,尤其是使用常规放疗联合免疫抑制剂产生远隔效应的报道,包括恶性淋巴瘤、肝癌、宫颈癌、黑色素瘤和结直肠癌。但对于术后复发转移胸腺癌患者在单纯碳离子放射治疗结束及后期随访中持续观察到远隔效应的病例报道却甚少。本病例碳离子治疗后产生的远隔效应一直持续至最后一次观察,距治疗结束已经1年。未经照射的肿瘤在没有接受其他任何治疗的情况下,在碳离子治疗结束后即出现缩小,且在后期随访的过程中持续缩小,并在增强CT上可以明确的观察到。尽管如此,未经照射的肿瘤产生免疫增强的机理仍未明确。免疫检查点抑制剂与放射治疗的并用,提高了肿瘤远隔效应的发生率。但是本案例并未接受过免疫或其他药物治疗,其远隔效应的产生完全来自于碳离子。单纯碳离子治疗产生远隔效应是因为肿瘤本身潜在的对射线的敏感性,还是患者免疫系统的特殊性,还是因为碳离子独特的物理和生物学优势而产生的远隔效应,较难鉴别。该机制是否与光子照射中产生的远隔效应有关,是否可以通过联合免疫治疗来进一步增强这一效应,需要做进一步研究。
参考文献
[1] Masashi K, Yusuke D, Junichi S, et al. Multicenter study of carbon-ion radiation therapy for mucosal melanoma of the head and neck: subanalysis of the Japan carbon-ion radiation oncology study group (J-CROS) study (1402 HN)[J]. Int J Radiat Oncol Biol Phys, 2018, 102(2):353-361.
[2] Kanai T, Endo M, Minohara S, et al. Biophysical characteristics of HIMAC clinical irradiation system for heavy-ion radiation therapy[J]. Int J Radiat Oncol Biol Phys, 1999, 44:201-210.
[3] Sharabi AB, Nirschl CJ, Kochel CM, et al. Stereotactic radiation therapy augments antigen-specific PD-1-mediated antitumor immune responses via cross-presentation of tumor antigen[J]. Cancer Immunol Res, 2015, 3(4):345-355. DOI: 10.1158/2326-6066.CIR-14-0196
初审:刘文玉
复审:张洁
