碳离子治疗肿瘤的临床进展研究
碳离子治疗肿瘤的临床进展研究
潘婷婷① 任益民①② 叶延程① 张雁山① 祁英① 马有国① 陈东基① 综述 陈威佐① 审校
摘要 碳离子束拥有独特的物理学及生物学优势,在肿瘤治疗过程中具有高效性和低毒性,并且整体治疗周期短,因此被认为21世纪最理想的肿瘤放射治疗射线。但是碳离子中心建设及设备运营费用昂贵,目前世界范围内,仅有日本、德国、中国、意大利、奥地利等极少数国家将碳离子应用于临床。自1994年以来,日本一直应用碳离子束治疗恶性肿瘤,治疗效果较好。截至2022年底,全球范围内超过46 800例患者接受了碳离子治疗,其中包括头颈部恶性肿瘤、肺癌、肝癌、胰腺癌等。本文总结近20年来碳离子在临床应用中的经验、治疗效果、最新发展及其作为一种新兴癌症治疗方式的优点,并将碳离子治疗与传统的光子放疗疗效及不良反应进行比较,可以帮助临床进一步了解碳离子治疗的优势及进展,并且指导关于新的碳离子治疗中心的建设,从而更好地服务于肿瘤患者。
关键词 碳离子束 碳离子束放疗 放射治疗 肿瘤
doi:10.12354/j.issn.1000-8179.2023.20230818
Clinical research progress of carbon ion radiotherapy for cancer
Tingting Pan1, Yimin Ren1,2, Yancheng Ye1, Yanshan Zhang1, Ying Qi1, Youguo Ma1, Dongji Chen1, Weizuo Chen1
Correspondence to: Weizuo Chen; E-mail: 15439951@qq.com
1 Department of Radiotherapy, Heavy Ion Center, Wuwei Cancer Hospital, Wuwei 733000, China; 2 Department of Radiation Oncology, Yee Zen General Hospital, Yang Mei, Taiwan Province, China
This work was supported by Gansu Province Science and Technology Innovation Talent Plan-Western Light "Western Young Scholars" Project (No. 23JR6KH034), Gansu Provincial Party Committee Organization Department Longyuan Youth Innovation and Entrepreneurship Talent Individual Project (No. 2022LQGR29) and Wuwei Science and Technology Bureau Science and Technology Planning Project (No. WW2002064)
Abstract
The use of carbon ion beam therapy for tumor treatment offers unique physical and biological advantages, high efficiency, low toxicity, and a short treatment cycle. Therefore, it is considered to be the most ideal radiation therapy for cancer in the 21st century. However, construction and equipment operation costs for a carbon ion center are prohibitive. Currently, carbon ions are only used for clinical purposes in Japan, Germany, China, Italy, Austria, and a few other countries. In Japan, patients with cancer have been treated with carbon ions since 1994, with strong positive effects. To date, over 46,800 patients worldwide have undergone carbon ion radiotherapy (CIRT) for conditions such as malignant head and neck tumors as well as lung cancer, liver cancer, pancreatic cancer, and other cancer types. We conducted a review encompassing over 20 years of global clinical experience with CIRT to summarize treatment outcomes, recent developments, and the merits of CIRT as an emerging cancer treatment modality. We also compare its efficacy and toxicity with those of photon radiotherapy. These findings can serve as a useful reference in decision-making and planning regarding new heavy ion centers to better serve patients with cancer.
Keywords: carbon ion beam, carbon ion radiotherapy (CIRT), radiotherapy, cancer
肿瘤放射治疗的主要目标为不断改善射线的剂量分布,将射线剂量最大化聚焦在肿瘤上,以减轻肿瘤周围正常器官的受量;不断提高射线的生物学效应,更有效地杀伤肿瘤细胞[1]。碳离子束放疗(carbon ion radiotherapy,CIRT)是21世纪最新兴的放疗方式,相较于光子在上述两个方面均具有明显优势。本文对CIRT临床治疗肿瘤的相关文献进行综述分析,整理治疗结果,并与光子疗效进行比较,为CIRT放疗的发展提供临床依据。
1 碳离子束的物理学和生物学优势
1.1 精确的剂量分布
常规放射治疗采用的光子射线(γ射线、X射线)以及电子线均属低线性能量传递(linear energy transfer,LET)射线,上述射线进入人体后产生的剂量随深度的增加而呈指数衰减,杀伤癌细胞的同时,周围正常组织会吸收到比更深层肿瘤还高的射线,从而引起近、远期并发症。而碳离子束属高LET射线,进入组织时,在其射程末端呈现剂量反转,出现Bragg峰,峰区之后照射剂量骤降为0。治疗过程中,调节Bragg峰位,将射线剂量最大化聚焦于靶区上,造成肿瘤细胞的最大化杀伤,同时最大限度保护周围正常组织[2],见图1。
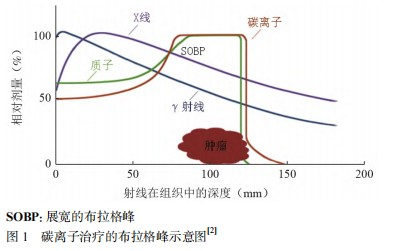
另外,碳离子运动方式近似直线,散射明显小于质子和光子,研究证明在20 cm(330 MeV)深的水中,碳离子束的横向散射仅为1.5 mm,而质子则高达6.5 mm。因此,CIRT具有更精确的剂量分布[3]。
1.2 理想的生物学效应
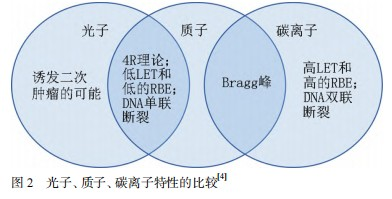
质子和光子的相对生物学效应(relative biological effect,RBE)相似,峰区约为1.0~1.1,其主要通过间接电离产生自由基,致使DNA双链或单链断裂,产生致死或亚致死性损伤;质子和光子射线对S、G0期及缺氧的肿瘤细胞几乎无杀伤能力,细胞周期依赖性强。而CIRT的RBE在Bragg峰区为2.5~3.0,CIRT通过直接电离导致大量的DNA双链断裂,造成致死性损伤,彻底杀死肿瘤细胞。且碳离子杀伤肿瘤细胞的能力与肿瘤细胞的氧浓度、周期分布、次致死损失修复等关系较小,传统放疗分次照射的“4R理论”不适用于碳离子[4],见图2。
2 碳离子治疗肿瘤的临床应用现状
国际粒子治疗联合会(PTCOG)网站资料显示,截至2023年10月全球有CIRT治疗中心14家,已超过4.6万余例患者接受了CIRT治疗。过去CIRT主要用于光子放疗不敏感或解剖复杂的肿瘤。随着经验的不断累积,CIRT治疗肿瘤的数量及种类也不断被拓展。
2.1 头颈部肿瘤
头颈部腺癌是一种罕见的肿瘤,光子治疗疗效差。2003年11月至2014年12月,日本多家重离子中心使用CIRT治疗头颈部腺癌患者47例,中位随访51个月,2年和5年总生存率(overall survival,OS)分别为87.9%和60.4%,2年和5年局部控制率(local control rate,LCR)分别为83.3%和79.3%[5]。2014年德国重离子研究学会报道CIRT治疗155例颅底脊索瘤患者的研究,CIRT中位总剂量为60 Gy(RBE)/20 F,3、5和10年的OS率分别为95%、85%和75%,且年龄<48岁和靶区体积>75 mL与LCR和OS率呈显著相关性,治疗期间及治疗后未发生较重的不良反应[6]。对比光子放疗,其5年LCR一般为23%~66%,CIRT已经被认为是脊索瘤的最佳放疗方式[7]。头颈部黏膜恶性黑色素瘤(malignant melanoma of the mucosa,MMM)对传统放疗抵抗。一项Meta分析共搜集2049例头颈部MMM患者,接受根治性光子放疗的患者生存率低于单独手术或手术+放疗组[8]。应用CIRT治疗后,MMM患者的生存明显改善,一项CIRT联合DAV方案治疗MMM的前瞻性临床研究,共纳入21例T4a/T4b期患者,3年OS率和无进展生存(progression-free survival,PFS)率分别为49.2%和37.0%,3年LCR为92.3%,无3级以上不良事件发生[9]。相较于普通光子放疗结果:LCR为0~61%,5年OS率在13%~18%之间,碳离子在治疗MMM具有绝对的优势[10]。眼底黑色素瘤的主要治疗方式是手术摘除,但摘除眼球严重影响患者生存质量及美观。为保留眼球,近距离斑块放疗与立体定向消融放疗是可选的替代疗法。既往报道的两项研究使用立体定向消融放射治疗眼底黑色素瘤,眼球保存率为79.7%和81.0%[11-12]。日本放射线医学综合研究所(NIRS)报告了CIRT治疗脉络膜色素瘤的临床试验,5年OS率和保眼率分别为80.8%和93.1%,在LCR与保眼率方面,CIRT与质子结果相似甚至更好,较高的保眼率可能是由于采用2野CIRT治疗,降低了新生血管性青光眼(neovascular glaucoma,NVG)的发生率[13]。
2.2 脑胶质瘤
脑胶质瘤是颅内最常见的原发肿瘤,全球每年发病率达5~6/10万[14]。光子放射治疗合并替莫唑胺是高级别脑胶质瘤的常规治疗方式,但疗效不佳。CIRT用于治疗脑胶质瘤始于20世纪90年代。一项高级别脑胶质瘤放疗后CIRT补量的临床研究共纳入48例患者,其中32例胶质母细胞瘤(glioblastoma,GBM),16例间变性星形细胞瘤,患者接受手术治疗、尼莫司汀化疗及常规光子放疗(50 Gy/25 F)后进行CIRT补量,根据CIRT剂量分为:低剂量组16.8 Gy(RBE),中剂量组18.4~22.4 Gy(RBE)和高剂量组24.8 Gy(RBE),三组的中位生存期(median overall survival,mOS)分别为7、19和26个月,无严重急慢性不良反应发生,单变量分析显示,CIRT剂量越高,疗效越好[15]。有研究对30例复发性高级别神经胶质瘤患者进行CIRT再程放疗,剂量为45 Gy(RBE)/15 F,诊断为复发性高级别胶质瘤后的mOS为13个月,该研究中复发性高级别神经胶质瘤的6、12和24个月OS率分别为76%、50%和19%,无4级以上不良反应出现[16]。高级别脑胶质瘤的治疗仍是医学难题,尤其是复发性高级别脑胶质瘤,CIRT的出现为该类患者提供了新的选择。研究显示,CIRT还可激活恶性脑胶质瘤凋亡诱导因子相关的Caspase独立通道,进一步促进肿瘤细胞死亡[4]。
2.3 乳腺癌
乳腺癌的标准治疗是手术±化疗±内分泌治疗±术后放疗。无法手术的乳腺癌患者可选择根治性放疗。日本文献报道18例可手术、分期ⅠA~ⅢC患者,接受光子根治性放疗,3年LCR达92%,且无皮肤晚期不良反应[17]。另一项研究在光子根治性放疗的基础上,增加了肿瘤内过氧化氢注射或热疗,5年LCR为93.4%,同样效果较好[18]。2013年4月日本开始了CIRT治疗Ⅰ期乳腺癌的临床研究,入选标准为cT1N0M0期初治乳腺癌,最初总剂量为52.8 Gy(RBE),4次/周,后提高至60 Gy(RBE),14例患者入组,除1例三阴性患者进展外,其余13例始终保持完全缓解状态,治疗效果较好[19]。研究证实,CIRT可以作为治疗乳腺癌的可选方案[20]。
2.4 肺癌
1994年NIRS进行了CIRT治疗非小细胞肺癌(non-small cell lung cancer,NSCLC)临床研究,共纳入Ⅰ期NSCLC患者179例,5年LCR、OS率分别为88.1%和74.9%,结果优于常规放疗的历史值,与手术治疗效果相似[21]。有研究报道了CIRT单次大剂量治疗NSCLC的长期随访结果,57例T1~2N0M0期的NSCLC患者入组,单次剂量50 Gy(RBE),中位随访时间61个月,3年和5年LCR分别为96.4%和91.8%,结果与手术效果相似,且未出现严重不良反应[22]。群马大学回顾性研究将CIRT大分割放疗与光子SBRT相比较,CIRT有更好的LCR,且肺损伤更小[23],对于合并肺纤维化、肺功能较差或复发后二次放疗的肺癌患者,治疗优势较大。
2.5 肝细胞肝癌
NIRS最早的CIRT治疗肝细胞性肝癌(hepatocellular carcinoma,HCC)研究确定52.8 Gy(RBE)/4 F为HCC患者推荐的最佳治疗剂量,明确了CIRT的低不良反应和良好的LCR[24]。高龄HCC患者CIRT治疗仍安全有效,一项研究纳入31例80岁以上HCC患者,结果显示两年OS率、LCR和无病生存率(disease-free survival rate,DFSR)分别为82.3%、89.2%和51.3%,无2级以上急性不良反应发生[25]。合并静脉癌栓的肝细胞性肝癌(locally advanced HCC,LAHCC)患者疾病复杂,治疗难度大,效果较差,而CIRT在治疗LAHCC方面的研究有了新的发现。一项评价CIRT治疗合并静脉癌栓的LAHCC患者疗效的临床研究,共纳入11例患者,结果显示3年OS率、LCR和PFS率分别为64%、78%和18%;而早期、原发病灶可切除的LAHCC患者手术治疗的3年OS率仅为13%~68%[26]。碳离子比光子具有更优的物理及生物学效应,在>1 cm的肝肿瘤中,正常肝脏的平均剂量可以从调强放疗的(18.8±3.7)Gy,降为CIRT的(12.8±2.7)Gy,这将使放射线引发的肝损伤几率从22.3%±30.0%下降至1.2%±2.4%[27]。光子SABR/SBRT用于LAHCC的根治性治疗的研究较多[28-29]。近期一项研究提示,LAHCC接受SABR光子放疗,2年及3年LCR分别为86.7%与84.2%[30]。此与上述CIRT研究报告的89.2%[25]相比,两者基本相似。然而CIRT肝损伤更低,CIRT有望成为LAHCC患者治疗的更好选择。
2.6 胰腺癌
胰腺癌的碳离子治疗最能体现CIRT的物理学及生物学优势。胰腺癌因富含大量乏氧细胞以及其他生物学特性,对光子放疗不敏感[31]。且其解剖位置深,周围被胃肠道等器官包绕,光子剂量明显受限。而CIRT治疗时胃肠道吸收的剂量远小于光子[32]。且CIRT治疗胰腺癌的RBE比光子高2~3倍[33],理论上可改善胰腺癌的预后。NIRS报道CIRT治疗可手术切除胰腺癌的临床研究,26例患者入组,行30.0~36.8 Gy(RBE)/8 F/2 W的术前治疗,其中21例患者接受了根治性切除,根治术患者5年LCR和OS率分别为100%和52%,有显著提高[34]。不可切除的胰腺癌,光子同步放化疗的mOS仅为10.0~11.1个月[35-36]。光子治疗胰腺癌的疗效实在不佳。有研究报道了CIRT治疗局部晚期胰腺癌患者的多中心临床研究,入组72例患者,56例患者(78%)接受同期化疗,1年和2年OS率分别为73%和46%,mOS为21.5个月,无4~5级不良发生[37]。对于术后局部复发胰腺癌的研究,CIRT也显示了较好的LCR,但OS率无明显改善,究其原因可能与胰腺癌已发生远处转移相关[38]。
2.7 前列腺癌
应用CIRT治疗前列腺癌的数量逐年增加。2017年日本报道了首个CIRT治疗前列腺癌的前瞻性研究,共纳入2157例患者,CIRT治疗剂量包括63~66 Gy(RBE)/20 F,57.6 Gy(RBE)/16 F,51.6 Gy(RBE)/12 F,低、中、高危患者5年无生化复发生存(biochemical recurrence-free survival,bRFS)率分别为92%、89%和92%,5年LCR分别为98%、96%和99%,肿瘤特异性生存率分别为100%、100%和99%[39]。另一项研究共纳入304例局限期前列腺癌患者,CIRT治疗剂量为57.6 Gy(RBE)/16 F,根据危险因素给予雄激素剥夺治疗(androgen deprivation therapy,ADT)治疗,5年LCR高达98.4%,5年OS率为96.6%,无3级以上急性不良反应发生[40]。根治性光子放疗对于前列腺癌的治疗,局部控制率与生存率均较好,碳离子的优势在于不良反应较低[41]。
2.8 骶骨脊索瘤
骶骨脊索瘤是碳离子治疗的又一优势病种。目前,骶骨脊索瘤的主要治疗方式为手术切除,但因肿瘤体积大、易侵犯邻近结构、术后并发症的风险以及解剖的复杂性,通常很难达到根治性切除,而切缘阳性未行放疗患者的OS明显低于CIRT(60.6个月 vs. 64.7个月)治疗,且CIRT后肛肠及泌尿系统不良反应发生率低于手术[42]。一项多中心研究共纳入219例骶骨脊索瘤患者,CIRT剂量为67.2 Gy(RBE)/16 F,5年OS率、PFS率和LCR分别为84%、48%和72%[43]。一项研究报道68例CIRT治疗骶骨脊索瘤的治疗,5年LCR、PFS率、无转移生存(metastasis-free survival,MFS)率和OS率分别为53%、53%、52%和74%,3级晚期不良反应发生率为21%,骶骨闭合性不全骨折是该研究最常见的晚期不良反应[44]。
2.9 非头颈部骨与软组织肉瘤
骨与软组织肉瘤种类繁多,个别肿瘤案例较少,传统光子放疗主要用于术前与术后的辅助治疗,可以提高LCR与OS率[45]。根治性光子放疗主要用于无法切除的肿瘤。有研究报道了128例不可手术切除的局限性中轴软组织肉瘤患者,应用CIRT治疗,3年、5年的LCR分别为68%和65%;mOS为42(6~146)个月,5年OS率和DFSR分别为46%和39%,其中43例患者生存期超过5年,该结果均优于既往报道的光子放疗结果(5年LCR分别为40%和45%;OS率分别为37%和35%)[46]。一项CIRT治疗四肢软组织肿瘤的前瞻性临床研究,共纳入13例患者,CIRT剂量为70.4 Gy(RBE)和67.2 Gy(RBE),中位随访时间31.8个月,3年OS率、PFS率、LCR分别为61.5%、44.9%和79.1%,除3级周围神经麻痹和关节运动障碍患者各1例外,无其他3级及以上不良反应发生[47]。手术是骨与软组织肿瘤的主要治疗方式,术后放疗是局部控制和功能保留的保障,CIRT作为最新的放疗技术,对于不能手术或术后辅助放疗的骨与软组织肿瘤患者可能是更好的选择。
2.10 其他
CIRT治疗胃肠道、宫颈、膀胱等空腔脏器肿瘤相关报道较少,究其原因主要为空腔脏器内存在气体或液体,密度不均匀,且蠕动性大,位置不易固定,导致CIRT治疗时射程和剂量的不确定,从而无法获得明确的疗效。因此,宫颈固定器具及膀胱定量器具等的定位、定量装置及Space OAR(生物可吸收聚乙醇酸间隔剂)在碳离子治疗中的应用将是未来临床研究的新方向。
3 结论与展望
CIRT相对于光子,对脑胶质瘤、头颈部肿瘤、肺癌、胰腺癌、骨与软组织肿瘤、骶尾部脊索瘤等疗效优于光子,这是基于CIRT的高RBE、高LET、Bragg峰等独特的物理及生物学优势。在肝癌、前列腺癌的治疗疗效方面与光子相当,但不良反应明显轻于光子。对于瘤体靠近脊髓、脑干、神经、肠道等重要、敏感器官的肿瘤患者,CIRT的不良反应明显小于光子,建议首选CIRT治疗。CIRT是集放射生物学、放射物理学、高能电子学等多学科于一体的最先进的放射治疗手段,目前正迅速在全球推广。越来越多高质量、多中心、前瞻性临床研究报道了CIRT较好的疗效,随着4D-CT、呼吸门控、主动扫描、大分割调强等先进技术的应用,不良反应的发生率已降至更低,患者体验舒适,治疗时间大幅缩短(多数患者在3周内完成治疗,部分患者甚至1天或在门诊完成治疗)。目前,CIRT唯一受限因素是由于设备建造和运营成本较高导致治疗费用高。今后随着建造技术的成熟会使建造和运营成本逐步下降。随着我国医保水平的提高,CIRT在不久的将来可能成为常规的治疗手段,给肿瘤放疗带来新的变革。
本文无影响其科学性与可信度的经济利益冲突。
参考文献
[1] 张雁山,叶延程,张红.碳离子束放射治疗肿瘤的临床进展[J].科技促进发展,2020,16(1):18-33.
[2] 马霄云,张雁山,张梦灵,等.重离子放射治疗靶区边缘剂量跌落分析[J].肿瘤学杂志,2021,27(5):390-394.
[3] Tsujii H, Kamada T, Shirai T, et al. Carbon-ion radiotherapy: principles, practices, and treatment planning[M]. Tokyo: Springer, 2014: 121-132.
[4] Mitchell G. The rationale for fractionation in radiotherapy[J]. Clin J Oncol Nurs, 2013, 17(4):412-417.
[5] Saitoh JI, Koto M, Demizu Y, et al. A multicenter study of carbon ion radiation therapy for head and neck adenocarcinoma[J]. Int J Radiat Oncol Biol Phys, 2017, 99(2):442-449.
[6] Uhl M, Mattke M, Welzel T, et al. Highly effective treatment of skull base chordoma with carbon ion irradiation using a raster scan technique in 155 patients: first long-term results[J]. Cancer, 2014, 120(21):3410-3417.
[7] Stacchiotti S, Gronchi A, Fossati P, et al. Best practices for the management of local-regional recurrent chordoma: a position paper by the Chordoma Global Consensus Group[J]. Ann Oncol, 2017, 28(6):1230-1242.
[8] Grant-Freemantle MC, Lane O'Neill B, Clover AJP. The effectiveness of radiotherapy in the treatment of head and neck mucosal melanoma: systematic review and meta-analysis[J]. Head Neck, 2021, 43(1):323-333.
[9] Takayasu Y, Kubo N, Shino M, et al. Carbon-ion radiotherapy combined with chemotherapy for head and neck mucosal melanoma: prospective observational study[J]. Cancer Med, 2019, 8(17):7227-7235.
[10] Lazarev S, Gupta V, Hu K, et al. Mucosal melanoma of the head and neck: a systematic review of the literature[J]. Int J Radiat Oncol Biol Phys, 2014, 90(5):1108-1118.
[11] Eibenberger K, Dunavoelgyi R, Gleiss A, et al. Hypofractionated stereotactic photon radiotherapy of choroidal melanoma: 20-year experience[J]. Acta Oncol, 2021, 60(2):207-214.
[12] Van Beek JGM, van Rij CM, Baart SJ, et al. Factionated stereotactic radiotherapy for uveal melanoma: Long-term outcome and control rates[J]. Acta Ophthalmol, 2022, 100:511-519.
[13] Toyama S, Tsuji H, Mizoguchi N, et al. Long-term results of carbon ion radiation therapy for locally advanced or unfavorably located choroidal melanoma: usefulness of CT-based 2-port orthogonal therapy for reducing the incidence of neovascular glaucoma[J]. Int J Radiat Oncol Biol Phys, 2013, 86(2):270-276.
[14] 中国抗癌协会脑胶质瘤专业委员会.中国抗癌协会脑胶质瘤整合诊治指南 (精简版)[J].中国肿瘤临床,2022,49(16):811-818.
[15] Mizoe JE, Tsujii H, Hasegawa A, et al. Phase Ⅰ/Ⅱ clinical trial of carbon ion radiotherapy for malignant gliomas: combined X-ray radiotherapy, chemotherapy, and carbon ion radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2007, 69(2):390-396.
[16] Eberle F, Lautenschläger S, Engenhart-Cabillic R, et al. Carbon ion beam reirradiation in recurrent high-grade glioma[J]. Cancer Manag Res, 2020, 12:633-639.
[17] Shibamoto Y, Murai T, Suzuki K, et al. Definitive radiotherapy with SBRT or IMRT boost for breast cancer: excellent local control and cosmetic outcome[J]. Technol Cancer Res Treat, 2018, 17:153-158.
[18] Shibamoto Y, Takano S, Iida M, et al. Definitive radiotherapy with stereotactic or IMRT boost with or without radiosensitization strategy for operable breast cancer patients who refuse surgery[J]. J Radiat Res, 2022, 63(6):849-855.
[19] Karasawa K, Omatsu T, Shiba S, et al. A clinical study of curative partial breast irradiation for stage Ⅰ breast cancer using carbon ion radiotherapy[J]. Radiat Oncol, 2020, 15(1):265.
[20] Malouff TD, Mahajan A, Mutter RW, et al. Carbon ion radiation therapy in breast cancer: a new frontier[J]. Breast Cancer Res Treat, 2020, 181(2):291-296.
[21] Jun-Ichi S, Katsuyuki S, Tatsuji M, et al. Hypofractionated carbon ion radiotherapy for stage Ⅰ peripheral nonsmall cell lung cancer (GUNMA0701): prospective phase Ⅱ study[J]. Cancer Med, 2019, 8(15):6644-6650.
[22] Ono T, Yamamoto N, Nomoto A, et al. Long term results of single fraction carbon-ion radiotherapy for non-small cell lung cancer[J]. Cancers (Basel), 2020, 13(1):112.
[23] Miyasaka Y, Komatsu S, Abe T, et al. Comparison of oncologic outcomes between carbon ion radiotherapy and stereotactic body radiotherapy for early-stage non-small cell lung cancer[J]. Cancers (Basel), 2021, 13(2):176.
[24] Kato H, Tsujii H, Miyamoto T, et al. Results of the first prospective study of carbon ion radiotherapy for hepatocellular carcinoma with liver cirrhosis[J]. Int J Radiat Oncol, 2004, 59(5):1468-1476.
[25] Shiba S, Abe T, Shibuya K, et al. Carbon ion radiotherapy for 80years or older patients with hepatocellular carcinoma[J]. BMC Cancer, 2017, 17(1):721.
[26] Shiba S, Shibuya K, Okamoto M, et al. Clinical impact of Hypofractionated carbon ion radiotherapy on locally advanced hepatocellular carcinoma[J]. Radiat Oncol, 2020, 15(1):195.
[27] Sun JY, Wang Z, Sheng Y, et al. Indications of IMRT, PRT and CIRT for HCC from comparisons of dosimetry and normal tissue complication possibility[J]. Strahlentherapie Und Onkologie, 2022, 198(4):361-369.
[28] Eriguchi T, Tsukamoto N, Kuroiwa N, et al. Repeated stereotactic body radiation therapy for hepatocellular carcinoma[J]. Pract Radiat Oncol, 2021, 11(1):44-52.
[29] Loi M, Comito T, Franzese C, et al. Stereotactic body radiotherapy in hepatocellular carcinoma: patient selection and predictors of outcome and toxicity[J]. J Cancer Res Clin Oncol, 2021, 147(3):927-936.
[30] Shanker MD, Moodaley P, Soon W, et al. Stereotactic ablative radiotherapy for hepatocellular carcinoma: a systematic review and meta-analysis of local control, survival and toxicity outcomes[J]. J Med Imaging Radiat Oncol, 2021, 65(7):956-968.
[31] Seshacharyulu P, Baine MJ, Souchek JJ, et al. Biological determinants of radioresistance and their remediation in pancreatic cancer[J]. Biochim Biophys Acta Rev Cancer, 2017, 1868(1):69-92.
[32] Yu Z, Hong ZS, Zhang Q, et al. Proton and carbon ion radiation therapy for locally advanced pancreatic cancer: a phase Ⅰ dose escalation study[J]. Pancreatology, 2020, 20(3):470-476.
[33] Sudo M, Tsutsui H, Hayashi S, et al. Autophagy inhibition increased sensitivity of pancreatic cancer cells to carbon ion radiotherapy[J]. Cell Physiol Biochem, 2023, 57(4):212-225.
[34] Shinoto M, Yamada S, Yasuda S, et al. Phase Ⅰ trial of preoperative, short-course carbon-ion radiotherapy for patients with resectable pancreatic cancer[J]. Cancer, 2013, 119(1):45-51.
[35] Loehrer PJ, Feng Y, Cardenes H, et al. Gemcitabine alone versus gemcitabine plus radiotherapy in patients with locally advanced pancreatic cancer: an Eastern Cooperative Oncology Group trial[J]. J Clin Oncol, 2011, 29(31):4105-4112.
[36] Herman JM, Wild AT, Wang H, et al. Randomized phase Ⅲ multi-institutional study of TNFerade biologic with fluorouracil and radiotherapy for locally advanced pancreatic cancer: final results[J]. J Clin Oncol, 2013, 31(7):886-894.
[37] Kawashiro S, Yamada S, Okamoto M, et al. Multi-institutional study of carbon-ion radiotherapy for locally advanced pancreatic cancer: Japan carbon-ion radiation oncology study group (J-CROS) study 1 403 pancreas[J]. Int J Radiat Oncol, 2018, 101(5):1212-1221.
[38] Liermann J, Ben-Josef E, Syed M, et al. Carbon ion radiotherapy as definitive treatment in locally recurrent pancreatic cancer[J]. Strahlenther Onkol, 2022, 198(4):378-387.
[39] Nomiya T, Tsuji H, Kawamura H, et al. A multi-institutional analysis of prospective studies of carbon ion radiotherapy for prostate cancer: a report from the Japan Carbon ion Radiation Oncology Study Group (J-CROS)[J]. Radiother Oncol, 2016, 121(2):288-293.
[40] Kawamura H, Kubo N, Sato H, et al. Moderately hypofractionated carbon ion radiotherapy for prostate cancer; a prospective observational study "GUNMA0702"[J]. BMC Cancer, 2020, 20(1):75.
[41] Li MX, Li XX, Yao L, et al. Clinical efficacy and safety of proton and carbon ion radiotherapy for prostate cancer: a systematic review and meta-analysis[J]. Front Oncol, 2021, 11:709530.
[42] Yolcu YU, Zreik J, Wahood W, et al. Comparison of oncologic outcomes and treatment-related toxicity of carbon ion radiotherapy and en bloc resection for sacral chordoma[J]. JAMA Netw Open, 2022, 5(1):e2141927.
[43] Demizu Y, Imai R, Kiyohara H, et al. Carbon ion radiotherapy for sacral chordoma: a retrospective nationwide multicentre study in Japan[J]. Radiother Oncol, 2021, 154:1-5.
[44] Bostel T, Mattke M, Nicolay NH, et al. High-dose carbon-ion based radiotherapy of primary and recurrent sacrococcygeal chordomas: long-term clinical results of a single particle therapy center[J]. Radiat Oncol, 2020, 15(1):206.
[45] Allignet B, Waissi W, Geets X, et al. Long-term outcomes after definitive radiotherapy with modern techniques for unresectable soft tissue sarcoma[J]. Radiother Oncol, 2022, 173:55-61.
[46] Imai R, Kamada T, Araki N, et al. Carbon ion radiotherapy for unresectable localized axial soft tissue sarcoma[J]. Cancer Med, 2018, 7(9):4308-4314.
[47] Takakusagi Y, Serizawa I, Koge H, et al. Clinical outcomes of scanning carbon-ion radiotherapy for soft tissue sarcoma of the extremities[J]. Anticancer Res, 2022, 42(7):3701-3706.
初审:刘文玉
复审:马树纤
