碳离子联合免疫治疗特殊部位复发性 鼻咽癌 1 例
碳离子联合免疫治疗特殊部位复发性鼻咽癌1例
Carbon Ion Radiotherapy Combined with Immunotherapy for Recurrent Nasopharyngeal Carcinoma in Special Site: A Case Report //
LI Xiao-jun, HU Ting-chao, ZHANG Yan-shan, YE Yan-cheng, ZHOU Jun-nian, MA Shu-ping, ZHANG Tian-e, WANG Yan, WANG Jian
李小军,胡廷朝,张雁山,叶延程,周俊年,马淑萍,张天娥,王艳,王健
(甘肃省武威肿瘤医院,甘肃武威 733000)
主题词:碳离子放射治疗;帕博利珠单抗;复发鼻咽癌;疗效
中图分类号:R739.63
文献标识码:B
文章编号:1671-170X(2022)12-1046-06
doi:10.11735/j.issn.1671-170X.2022.12.B013
鼻咽癌的发病具有特殊的地域流行特征,从全球范围来看,中国南部和东南亚是鼻咽癌的高发区域。据统计,中国南部区域鼻咽癌男性发病率高达30.29/10万,女性为13.09/10万[1]。放射治疗是鼻咽癌的主要治疗手段,随着影像诊断技术的进步、调强放射治疗技术以及化疗、靶向治疗的应用,早期和局部晚期鼻咽癌的生存率有了明显提升,且预后良好,5年生存率为85%~90%[2-4],但仍有10%的患者在原发部位和/或区域部位有残留或复发。《鼻咽癌复发、转移诊断专家共识》(2018)指出[5],复发鼻咽癌的主要治疗手段有再程放疗、挽救性手术、化疗、靶向治疗和免疫治疗等。再程放疗的方式主要包括调强放疗(intensity modulated radiation therapy, IMRT)、立体定向放疗(stereotactic radiotherapy, SRT)以及质子和碳离子放疗等[6-7]。然而鼻咽癌肿瘤组织常有供血不足及乏氧细胞对放化疗有抗拒性,部分癌细胞可逃避放射性损伤,依靠无氧酵解供能继续保持存活功能[8]。部分肿瘤侵犯颅底、斜坡、海绵窦等区域,因放疗正常组织剂量限制,无法达到根治性剂量,成为肿瘤复发的根源。碳离子放疗因其能量沉积在射程末端形成布拉格峰,侧向散射小,剂量边缘清晰,有利于精确治疗(毫米量级),可最大限度地减少对周围组织的辐射损伤。碳离子束还具有较高的相对生物学效应(relative biological effectiveness, RBE),所致的DNA损伤为双键断裂,难以修复。因此,这些特性有利于治疗对辐射不敏感、解剖关系复杂的复发性头颈部肿瘤。多项研究证实,免疫检查点抑制剂(immune checkpoint inhibitor, ICI)联合标准方案化疗用于复发和转移的鼻咽癌治疗,可以产生协同作用,疗效优于单纯化疗,可能与化疗对肿瘤新生抗原暴露和肿瘤免疫微环境的影响相关[9]。因此近年来学者不断探索以寻找更有效的治疗方案,本中心采用碳离子放疗联合免疫检查点抑制剂帕博利珠单抗(Pembrolizumab, Keytruda)6周方案治疗1例鼻咽癌放疗后颅底复发,并寰椎和小脑幕受侵病例。虽其复发部位特殊,治疗难度大,但在治疗后6个月实现了肿瘤完全消失并保持无病生存16个月,现报道如下。
1 临床资料
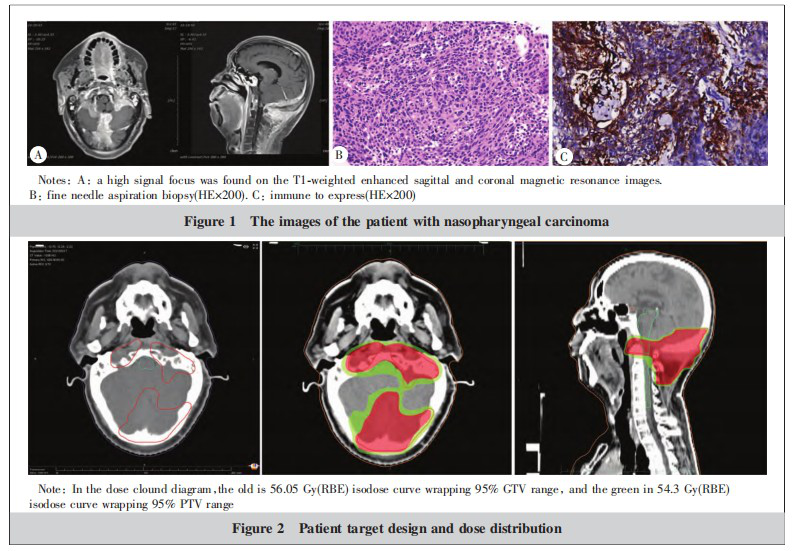
患者,男性,55岁,以“鼻咽癌放疗后4年,确诊颅底复发1年”为主诉入院。2017年12月因“鼻塞、流浊涕”行鼻咽镜提示:双侧鼻咽部可见隆起新生物,表面不光滑。病检示:(鼻咽部)低分化鳞状细胞癌(非角化性癌,未分化型)。IHC:CK(+),CK5/6(++),P40(+),LCA(淋巴细胞+),P53(15%+),Ki-67(50%+),PD-1(-),PD-L1(-),EBER原位杂交(+)。临床分期cT4N1M0,ⅣA期。于2017年12月至2018年1月采用多西他赛+奈达铂(TP)方案新辅助化疗3个周期,2018年1月至2月行鼻咽癌根治性容积调强适形放疗,肿瘤靶体积(GTV)处方剂量DT 70 Gy/31 F,期间予同步尼妥珠单抗周方案靶向治疗6周,放疗后疗效评价CR。2018年3~7月口服替吉奥化疗6个周期。2018年11月至2020年8月间断口服卡培他滨“节拍化疗”。2020年9月鼻咽部MR示:鼻咽壁轻度增厚,较前未见明显变化。颅底骨质破坏,考虑肿瘤浸润,枕骨骨质破坏并周围软组织肿块,范围约66 mm×64 mm×51 mm,考虑肿瘤复发转移并受侵。2020年9~11月采用顺铂+氟尿嘧啶(DF)方案联合西妥昔单抗化疗3个周期。2020年11~12月顺铂+白蛋白紫杉醇(TP)方案化疗2个周期,2020年12月至2021年7月顺铂+吉西他滨(GP)方案联合纳武利尤单抗+西妥昔单抗化疗9个周期,疗效评价PD。2021年9月鼻咽部MRI示(Figure 1A):鼻咽癌放疗后枕骨斜坡复发,枕骨骨质破坏并颅内外软组织肿块形成,寰椎局部包绕其中,复发转移。枕骨病变穿刺病检示:纤维组织转移癌,结合免疫组化、原位杂交结果及临床病史,考虑鼻咽癌转移。免疫组化结果显示(Figure 1B):CK5/6(+),Ki-67(约20%+),LCA(–),P40(+),原位杂交结果显示:EBER(+)。免疫表达(Figure 1C):PD-L1肿瘤细胞阳性比例分数(tumor proportion score, TPS)50%~60%,综合阳性分数(combined positive score, CPS)60。临床诊断为:鼻咽未分化型非角化性癌放化疗后复发,化疗及免疫治疗后rcT4N0M1 ⅣB期,ECOG评分1分。
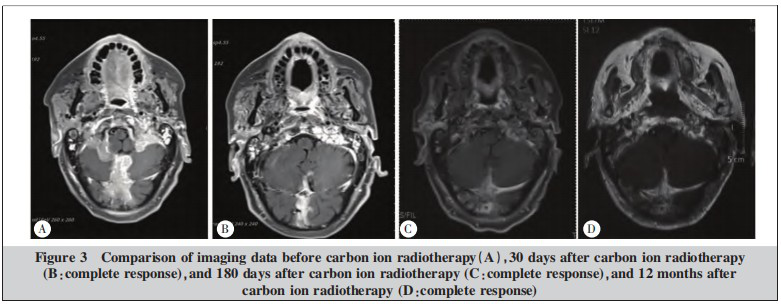
经过全面检查和评估,患者于2021年9月接受主动式束流配送碳离子放疗,治疗计划在ciPlan1.0版系统(中国兰州近代物理研究所)上制定。靶区勾画(Figure 2A):GTV勾画为CT、MRI可见的复发及受侵病灶,PTV在CTV基础上外扩3 mm,危及器官勾画包括脊髓、脑干、小脑、颞颌关节、下颌骨等。采用3D点扫描技术放疗,采用左右对穿野照射病灶,总剂量为57 Gy(RBE)/19 F,3.0 Gy(RBE)/F,5 F/w(Figure 2)。分析体积直方图(dose volume histogram, DVH)提示:56.05 Gy(RBE)等剂量曲线包绕95%GTV,54.3 Gy(RBE)等剂量曲线包绕95%PTV。脑干Dmax=10.34 Gy(RBE)。碳离子治疗前、治疗后30 d、180 d、12个月影像学资料疗效对比,治疗后30 d疗效达完全缓解(complete response, CR)(Figure 3)。碳离子治疗后30 d内照射野枕部皮肤出现轻度红斑及干性脱皮,按照RTOG急性放射损伤分级评为1级放射性皮肤损伤,没有观察到大于2级的不良反应。碳离子治疗期间采用免疫联合放疗治疗模式,依据KEYNOTE-028研究采用了三线单药帕博利珠单抗挽救性治疗,采用最新剂量方案,帕博利珠单抗从200 mg 3周/次剂量转换为400 mg 6周/次使用至今。截至2022年9月(肿瘤消失后12个月),目前患者存活,无病状态,下阶段继续完成5年长期随访计划。


2 讨论
对于局部或区域复发的鼻咽癌治疗方法包括手术、再程放疗、化疗、靶向和免疫治疗,各种单一治疗模式存在局限性。再程放疗是有效的挽救性治疗手段,特别是对于复发间隔超过1年的患者。再程放疗需要充分评估首程放疗的强度、复发的时间间隔、正常组织的耐受情况、再次放疗剂量可能带来的近期和远期毒性。T1期和T2期复发性鼻咽癌可以进行再程放疗与微创手术,由于病灶局限再程放疗效果良好,相关毒性低。微创手术尤其是内镜下鼻咽部切除术与达芬奇机器人微创鼻咽癌切除术在治疗早期复发鼻咽癌中具有重要地位,两种治疗手段疗效优劣需要进一步探讨。T3期和T4期复发鼻咽癌患者的再放疗毒性高、反应性差,治疗相关病死率非常高,其中40%以上死于黏膜坏死或大出血,进食困难和放射性脑病也是引起5级毒性反应的常见原因,而质子、重离子治疗有望成为理想的治疗方式。同步化疗有助于改善复发鼻咽癌患者的预后,但会加重放疗毒副反应,是否行诱导化疗有待开展前瞻性随机对照研究进一步探讨。免疫检查点抑制剂在复发转移性鼻咽癌治疗中已初见疗效,但单用PD-1/PD-L1免疫检查点抑制剂有效率相对较低,联合化疗有望显著改善复发鼻咽癌患者的疗效,长期确切疗效需进一步研究证实。放疗联合免疫治疗已在初治肿瘤中获得协同疗效,但放疗联合免疫治疗复发鼻咽癌,特别是免疫联合碳离子治疗复发鼻咽癌临床中尚未见报道。
对于局部复发鼻咽癌,再程放疗是一个挑战,因为既往辐射剂量已接近周围正常组织耐受极限,需要在局部抢救治疗和尽量减少治疗毒性之间取得平衡。李嘉欣等[10]收集了337例首次复发鼻咽癌患者的病例资料,统计分析影像学显示肿瘤侵犯部位中颅底、副鼻窦、颅神经、海绵窦、颅内、翼腭窝、颞下窝、眶尖的复发率较高。上述区域由于位于功能区、解剖结构复杂,受正常组织剂量限制,存在低剂量区,肿瘤细胞受到的多为亚致死性损伤,经过修复后存活下来并继续分裂导致肿瘤复发。复发后再程放疗常因二程放疗危及器官限量无法实现。先前已有碳离子治疗复发鼻咽癌疗效和毒副反应的报道。2016年上海质子重离子医院报道了评价碳离子放疗+化疗对鼻咽癌局部复发的挽救性治疗Ⅰ/Ⅱ期临床试验的试验方案[11],预期较光子放疗改善疗效和毒性反应,将2年总生存率从历史的50%提高到至少70%。2018年Hu等[12]公布了初期研究结果,2015年5月至2017年8月入组75例接受调强碳离子放疗(intensity modulated carbon ion radiotherapy, IMCR)抢救治疗的复发鼻咽癌患者,Ⅰ期、Ⅱ期、Ⅲ期和ⅣA/B期分别为4、14、29、28例,IMCR剂量为50~66 Gy(RBE),1年总生存率为98.1%,无局部区域复发生存率为86.6%,无远处转移生存率达96.2%,治疗期间未发生2级以上急性毒性反应。晚期严重毒性反应(3级或4级)不常见,包括黏膜坏死(7例)、口干(1例)和颞叶坏死(1例)。目前,本中心也积累了一定数量的碳离子治疗复发头颈部肿瘤的临床病例,治疗结果令人鼓舞。
本中心马霄云等[13]重离子放射治疗靶区边缘剂量跌落分析结果显示,重离子束由于其独特的物理学特性,靶区边缘剂量跌落非常迅速,重离子射束后缘在距95%等剂量线5 mm处,可衰减70%~80%。在射野后缘1 mm的距离,剂量即可衰减8%~19%左右[14],X/γ射线放疗和重离子放疗相比,重离子束流的剂量跌落速度更快。重离子可以对一些特别靠近危及器官的靶区进行安全、足量的放射治疗。我们报道的此病例复发部位位于颅底并寰椎和小脑幕,靶区呈不规则分布,病灶邻近小脑,环形包绕延髓,IMRT和SRT无法实现靶区剂量分布。碳离子具有物理和生物学优势,采用碳离子点扫描放疗可完美实现再程放疗,首先通过迷你型脊型过滤器(miniSOBP)把单能束流尖锐的Bragg峰展宽[15],主动式束流配送时,改变粒子能量,从而改变离子束入射深度,利用磁扫描系统引导笔形束对肿瘤靶区进行三维扫描适形治疗[16]。高剂量分布区(Bragg峰)被调整嵌合在肿瘤靶区上,射野后缘距95%等剂量线3 mm处,剂量快速跌落50%~60%,且碳离子在Bragg峰区具有较高RBE,峰区与坪区之间的RBE值差别最大,使位于坪区的延髓和小脑少受损伤。
目前,大部分复发性鼻咽癌不适合局部常规再程治疗和手术治疗,主流治疗方案是姑息性系统化疗。对于一线含铂方案治疗失败的患者,通常选择一线未使用的药物进行单药治疗,2020年4个国产免疫单药POLARIS-02研究(特瑞普利单抗)、CAPTAIN研究(卡瑞利珠单抗)、BGB-A317-102研究(替雷利珠单抗)、AK-105研究(派安普利单抗)公布了标准治疗失败的复发和转移鼻咽癌的研究数据。KEYNOTE-028研究[17]公布了帕博利珠单抗在复发转移性鼻咽癌(PD-L1 TPS≥1)中抗肿瘤活性和安全性评价结果,中位随访20个月,客观缓解率25.9%。我们报道的此病例,2020年9月复发后先后采用DF方案、TP方案、GP方案化疗,并联合靶向药物西妥昔单抗,免疫检查点抑制剂纳武利尤单抗治疗,肿瘤仍未控。入院后枕部复发病灶穿刺取检复测免疫表达,PD-L1肿瘤细胞阳性比例分数50%~60%,综合阳性分数60。对于此例一、二线治疗均失败患者,依据KEYNOTE-028研究采用了三线单药帕博利珠单抗挽救性治疗,并评估碳离子放疗可行性,联合放射治疗。药物使用中进行了剂量转换,帕博利珠单抗从200 mg 3周/次转换为400 mg 6周/次使用,未见诱发或加重免疫相关性不良事件,与2022年7月日本学者在胸部肿瘤杂志发表的晚期非小细胞肺癌中剂量转换研究结果一致[18]。
基础研究显示,免疫治疗联合放疗通过以下两方面协同增益:(1)放疗可激活抗肿瘤免疫并重构免疫微环境,增加免疫治疗抗肿瘤活性[19-21]。放疗不仅通过诱导适应性抗肿瘤免疫应答,而且可通过修饰免疫微环境中关键免疫细胞的特性,将免疫原性差的肿瘤转化为免疫原性更高的肿瘤,从而增强抗肿瘤免疫反应,并且无论低和高剂量放疗均促进免疫刺激和免疫抑制免疫细胞上调。(2)免疫治疗可对放疗起增敏作用,使得肿瘤细胞对放疗更敏感[22]。肿瘤血管系统异常和功能失调导致肿瘤细胞乏氧后形成放疗抗拒,免疫检查点抑制剂通过T细胞依赖的途径诱导血管正常化,逆转肿瘤局部的乏氧微环境和细胞浸润,通过这种改善作用增加了肿瘤组织的放疗敏感性,进一步增加了肿瘤退缩。这种作用通常见于大分割治疗SRT[23],高LET射线(high linear energy transfer 高线性能量传递射线),如碳离子的放射治疗[24]。因碳离子放疗可直接破坏肿瘤细胞的DNA双链结构,更容易诱发机体的抗肿瘤免疫,增强了肿瘤细胞相关抗原呈递,提高了免疫系统对肿瘤的识别,从而与抗PD-1/PD-L1单抗联合可产生协同作用和诱发远隔效应。此前本中心报道了1例恶性胸腺瘤单纯碳离子放射治疗后远隔效应[25],治疗结束时即观察到治疗区及治疗区外,肿瘤均明显缩小。
与再程调强放疗相比,质子和重离子放疗均可进一步减少对正常组织的损伤[26-27],虽然目前尚缺乏随机对照研究,但小样本的回顾性研究提示质子和重离子放疗技术在复发和转移鼻咽癌中具有重要应用前景[28]。对于本例复发鼻咽癌碳离子联合免疫检查点抑制剂治疗,取得了良好的效果,没有发生大于2级的不良反应。在治疗后实现了肿瘤完全消失并保持无病12个月,目前总生存期13个月,实现了特殊部位复发的再程放疗。显示了碳离子优越的物理和生物学优势,危及器官离靶区特别近的疑难病例,碳离子放疗可以在满足靶区剂量要求的基础上,将紧邻的危及器官剂量降低至限值以内。
综上,碳离子联合免疫治疗可能成为复发和转移鼻咽癌一种安全有效的治疗方法,但临床观察还需要更长的随访时间和更多的数据来评估其有效性和晚期毒副反应。
参考文献
[1] Zhang LF, Li YH, Xie SH, et al. Incidence trend of nasopharyngeal carcinoma from 1987 to 2011 in Sihui County, Guangdong Province, South China: an age-period cohort analysis[J]. Chin J Cancer, 2015, 34(8): 350–357.
[2] Becker-Schiebe M, Christiansen H. Update zur kombinierten radio-, radiochemo- und alleinigen Chemotherapie bei der multimodalen Therapie des Nasopharynxkarzinoms--eine MAC-NPC-Metaanalyse[Update on combined radio-, radiochemo-, and chemotherapy alone in multimodal therapy of nasopharyngeal carcinoma --a MAC NPC meta-analysis][J]. Strahlenther Onkol, 2015, 191(12): 991–993.
[3] Yang L, Hong S, Wang Y, et al. Development and external validation of nomograms for predicting survival in nasopharyngeal carcinoma patients after definitive radiotherapy[J]. Sci Rep, 2015, 26(5): 15638.
[4] Perri F, Della Vittoria Scarpati G, et al. Combined chemoradiotherapy in locally advanced nasopharyngeal carcinomas[J]. World J Clin Oncol, 2013, 4(2): 47–51.
[5] 李金高,陈晓钟,林少俊,等. 鼻咽癌复发、转移诊断专家共识[J]. 中华放射肿瘤学杂志,2018,27(1): 7–15.
[6] Helbig L, Koi L, Brüchner K, et al. Hypoxia-inducible factor pathway inhibition resolves tumor hypoxia and improves local tumor control after single-dose irradiation[J]. Int J Radiat Oncol Biol Phys, 2014, 88(1): 159–166.
[7] Lee AWM, Ng WT, Chan JYW, et al. Management of locally recurrent nasopharyngeal carcinoma[J]. Cancer Treat Rev, 2019, 79(9): 101890.
[8] Dizman A, Coskun-Breuneval M, Altinisik-Inan G, et al. Reirradiation with robotic stereotactic body radiotherapy for recurrent nasopharyngeal carcinoma[J]. Asian Pac J Cancer Prev, 2014, 15(8): 3561–3566.
[9] Meric-Bernstam F, Larkin J, et al. Enhancing anti-tumour efficacy with immunotherapy combinations[J]. Lancet, 2021, 397(10278): 1010–1022.
[10] 李嘉欣,卢泰祥,黄莹,等. 337例复发鼻咽癌患者的临床特征[J]. 癌症,2010,29(1): 82–86.
[11] Kong L, Gao J, Hu J, et al. Phase I/II trial evaluating concurrent carbon-ion radiotherapy plus chemotherapy for salvage treatment of locally recurrent nasopharyngeal carcinoma[J]. Chin J Cancer, 2016, 35(1): 101.
[12] Hu J, Bao C, Gao J, et al. Salvage treatment using carbon ion radiation in patients with locoregionally recurrent nasopharyngeal carcinoma: Initial results[J]. Cancer, 2018, 124(11): 2427–2437.
[13] 马霄云,张雁山,张梦灵,等. 重离子放射治疗靶区边缘剂量跌落分析[J]. 肿瘤学杂志,2021,27(5): 390–394.
[14] 王金媛,鞠忠建,王小深,等. 椎体转移瘤立体定向放射治疗剂量跌落梯度分析[J]. 中国医学装备,2015,12(9): 1–5.
[15] 盛尹祥子,Kambiz Shanazi,王巍伟,等. 点扫描质子束治疗机头的蒙特卡罗模拟和验证[J]. 中华放射医学与防护杂志,2019(8): 635–640.
[16] 李小波,江柳清,吴晓东,等. 高剂量格栅状放疗技术及应用[J]. 中华放射肿瘤学杂志,2018,27(6): 624–628.
[17] Hsu C, Lee SH, Ejadi S, et al. Safety and Antitumor activity of pembrolizumab in patients with programmed death-ligand 1-positive nasopharyngeal carcinoma: results of the KEYNOTE-028 study[J]. J Clin Oncol, 2017, 35(36): 4050–4056.
[18] Higashiyama RI, Yoshida T, Yagishita S, et al. Safety implications of switching Pembrolizumab dosage from 200 mg every 3 weeks to 400 mg every 6 weeks in patients with advanced NSCLC[J]. J Thorac Oncol, 2022, 17(10): 1227–1232.
[19] Keam S, Gill S, Ebert MA, et al. Enhancing the efficacy of immunotherapy using radiotherapy[J]. Clin Transl Immunology, 2020, 9(9): e1169.
[20] Bernstein MB, Krishnan S, Hodge JW, et al. Immunotherapy and stereotactic ablative radiotherapy (ISABR): a curative approach[J]. Nat Rev Clin Oncol, 2016, 13(8): 516–524.
[21] Herrera FG, Bourhis J, Coukos G. Radiotherapy combination opportunities leveraging immunity for the next oncology practice[J]. CA Cancer J Clin, 2017, 67(1): 65–85.
[22] Wang Y, Liu ZG, Yuan H, et al. The reciprocity between radiotherapy and cancer immunotherapy[J]. Clin Cancer Res, 2019, 25(6): 1709–1717.
[23] Xing D, Siva S, Hanna GG. The abscopal effect of stereotactic radiotherapy and immunotherapy: fool's gold or El Dorado[J]. Clin Oncol (R Coll Radiol), 2019, 31(7): 432–443.
[24] Harada K, Nonaka T, Hamada N, et al. Heavy-ion-induced bystander killing of human lung cancer cells: role of gap junctional intercellular communication[J]. Cancer Sci, 2009, 100(4): 684–688.
[25] Zhang YS, Zhang YH, Li XJ, et al. Bystander effect and abscopal effect in recurrent thymic carcinoma treated with carbon-ion radiation therapy: a case report[J]. World J Clin Cases, 2021, 9(22): 6538–6543.
[26] Akbaba S, Ahmed D, Lang K, et al. Results of a combination treatment with intensity modulated radiotherapy and active raster-scanning carbon ion boost for adenoid cystic carcinoma of the minor salivary glands of the nasopharynx[J]. Oral Oncol, 2019, 91(4): 39–46.
[27] Amirul Islam M, Yanagi T, Mizoe JE, et al. Comparative study of dose distribution between carbon ion radiotherapy and photon radiotherapy for head and neck tumor[J]. Radiat Med, 2008, 26(7): 415–421.
[28] Chen YP, Chan ATC, Le QT, et al. Nasopharyngeal carcinoma[J]. Lancet, 2019, 394(10192): 64–80.
初审:马树纤
复审:刘文玉
