Ⅲ期非小细胞肺癌碳离子放疗与光子容积旋转调强放疗的剂量学对比研究
Ⅲ期非小细胞肺癌碳离子放疗与光子容积旋转调强放疗的剂量学对比研究
李小军,张雁山,任益民,张一贺,叶延程,马 彤,芦 静,潘 鑫,马淑萍
A Dosimetric Comparative Study of Carbon-Ion Radiotherapy Versus X-Ray Volumetric Modulated Arc Therapy for Stage III Non-Small Cell Lung Cancer
LI Xiaojun, ZHANG Yanshan, REN Yimin, ZHANG Yihe, YE Yancheng, MA Tong, LU Jing, PAN Xin, MA Shuping
Heavy Ion Radiotherapy Department, Wuwei Tumor Hospital of Gansu Province, Gansu Wuwei 733000, China
Abstract
Objective: To examine whether two-dimensional carbon-ion radiotherapy (2D-CIRT) is dosimetrically superior to photon beam volumetric modulated arc therapy (VMAT) in the treatment of stage III non-small cell lung cancer (NSCLC), and provide a basis for clinical carbon ion therapy. Methods: Thirteen patients with stage III NSCLC in our center who were planned with 2D-CIRT using the CiPlan planning system and VMAT using the Eclipse planning system were selected. The optimization constraints of the two designs were basically the same. Target dose distribution and organ-at-risk (OARs) doses were evaluated using dose-volume histograms (DVH). SPSS 22.0 software was used for data analysis.
Results: Both CIRT and VMAT plans had good tumor coverage with no significant differences in D98, D95, and D50 of PTV1 between the two plans. The homogeneity index (HI) between the two plans was similar (CIRT vs VMAT: 0.39 vs 0.38, P > 0.05). There were significant differences in D98, D95, and D50 of PTV2 between the two plans. The HI of PTV2 was significantly superior in the CIRT plan (CIRT vs VMAT: 0.08 vs 0.16, P < 0.05). The V5, V10, V20, V30, V40, and Dmean of the contralateral lung in the CIRT plan were significantly reduced compared with the photon VMAT. The V5 of the ipsilateral lung was slightly lower in the CIRT plan (CIRT vs VMAT: 53.0% vs 64.4%, P < 0.05). There were no differences between the two groups in V10, V20, V30, V40, and Dmean. CIRT had a lower spinal cord Dmax (CIRT vs VMAT: 18.61 Gy vs 43.03 Gy, P < 0.0001), esophageal Dmean (CIRT vs VMAT: 16.25 Gy vs 20.38 Gy, P = 0.031), and V50 (CIRT vs VMAT: 4.49% vs 11.43%, P = 0.005), V10 and V30 of bone, and the V50 of the trachea and bronchial tree.
Conclusion: Compared with photon VMAT, 2D-CIRT using passive beam scanning technology significantly reduces radiation dose to OARs in the treatment of stage III NSCLC, suggesting better protection of normal tissues.
Keywords:carbon ion radiotherapy, non-small cell lung cancer, volumetric modulated arc therapy, dosimetric comparison, dose-volume parameters
Modern Oncology 2023, 31(02): 0337-0343
【摘要】目的:比较碳离子二维放射治疗(two-dimensional carbon-ion radiotherapy,2D-CIRT)计划与光子容积调强放射治疗(volume modulated arc therapy,VMAT)计划在Ⅲ期非小细胞肺癌中剂量学优劣,为临床碳离子治疗提供依据。方法:选取我中心13例Ⅲ期非小细胞肺癌患者,使用相同的处方剂量及危及器官约束条件,分别在Ciplan计划系统上设计2D-CIRT计划和Eclipse计划系统上设计VMAT计划,比较剂量-体积直方图,评价靶区剂量分布及危及器官受量。采用SPSS 22.0软件进行数据分析。结果:CIRT和VMAT计划肿瘤覆盖率均较好,PTV1的D98、D95、D50差异无统计学意义,两种计划的均匀性指数(homogeneity index,HI)相似(CIRT与VMAT:0.39 Gy与0.38 Gy,P>0.05)。PTV2两种方案在D95、D98、D50、D2均有显著性差异,PTV2采用CIRT的HI也明显优于VMAT(CIRT vs VMAT:0.08 Gy vs 0.16 Gy,P=0.003)。与光子VMAT相比,CIRT计划中健侧肺的V5、V10、V20、V30、V40和Dmean明显降低。患侧肺中CIRT的V5低于VMAT(CIRT vs VMAT:53.00 vs 64.41,P=0.003),V10、V20、V30、V40、Dmean两种计划均无统计学差异;CIRT有较低的脊髓Dmax(CIRT vs VMAT:18.61 Gy vs 43.03 Gy,P=0.000)、食管Dmean(CIRT vs VMAT:16.25 Gy vs 20.38 Gy,P=0.031)和V50(CIRT vs VMAT:4.49 Gy vs 11.43 Gy,P=0.005)、骨V10和V30,以及气管和支气管树的V50。结论:与光子VMAT相比,2D-CIRT被动束流扫描技术在Ⅲ期非小细胞肺癌治疗中显著降低了对危及器官的辐射剂量,对正常组织有更好的保护作用。
【关键词】碳离子放疗;非小细胞肺癌;容积旋转调强放疗;剂量学对比;DVH
【中图分类号】R734.2 【文献标识码】A DOI:10.3969/j.issn.1672-4992.2023.02.027
【文章编号】1672-4992-(2023)02-0337-06
国际肿瘤研究机构(International Agency for Research on Cancer, IARC)2018年发布了全球癌症状况的研究数据。据统计,2018年全球肺癌新增诊断病例约209万例,死亡176万例。肺癌是最常见的癌症之一,占总癌症病例数的11.6%,死亡人数占全球癌症死亡总数的18.4%,现已成为全球常见癌症死亡率第一的癌症[1]。据统计,2015年肺癌发病率及死亡率在国内均排第1位[2]。其中,非小细胞肺癌(non-small cell lung cancer, NSCLC)占全部肺癌病例的80%,其中35%的病例在初诊时即为局部晚期非小细胞肺癌(locally advanced non-small cell lung cancer, LA-NSCLC)[3]。对于无法手术或不能耐受手术的LA-NSCLC患者,其标准治疗是同期放化疗,但RTOG 0617研究表明高剂量放疗(74 Gy)并不能改善Ⅲ期非小细胞肺癌患者生存,并增加治疗相关死亡率。这些研究采用的是常规光子调强放疗技术,目前质子重离子等粒子放疗在对肿瘤实施精确和足量放疗的同时可使正常器官损伤最小。
碳离子与常规X射线相比,具有物理和生物学优势。碳离子束具有Bragg峰和锐利的半影,可使高剂量区完美地嵌合在肿瘤靶区上[4-5],显著地保护正常组织[6]。碳离子为高线性能量传递(linear energy transfer, LET)射线,生物学效应约为X射线的3倍[7-8],更低的氧增敏比,这些优势可提高对肿瘤的杀伤和治疗安全性[9-11]。鉴于以上优势,采用高剂量碳离子放疗是否与光子高剂量放疗临床结局不同,首先要进行剂量学研究。本文对Ⅲ期非小细胞肺癌采用高处方剂量72 Gy/Gy[相对生物学有效性(relative biological effectiveness, RBE)](RBE=3.0),比较碳离子二维放射治疗(2-dimensional carbon-ion radiotherapy, 2D-CIRT)计划与光子容积旋转调强放射治疗(volumetric intensity-modulated arc therapy, VMAT)计划在靶区及危及器官的具体剂量学差异,以探讨两者之间的优劣与治疗价值,现报告资料如下。
1.资料与方法
1.1 一般资料
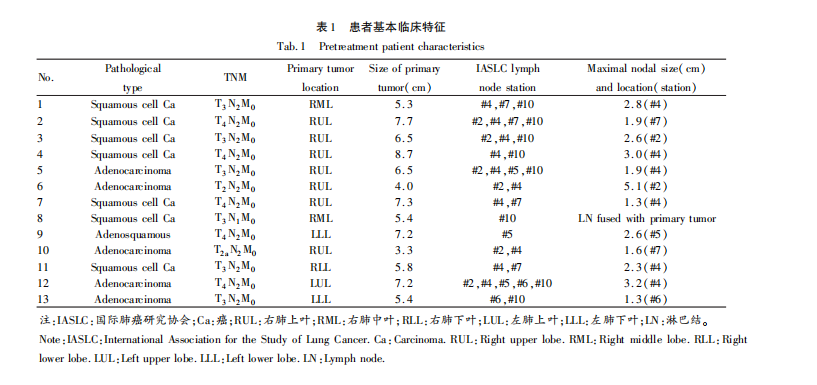
纳入2018-2021年期间在我中心接受碳离子被动束均匀扫描二维放射治疗的13例Ⅲ期NSCLC患者。因碳离子放射治疗装置在多叶准直器下的最大照射野大小为12 cm×12 cm,排除不能单野治疗患者。10例为右肺癌,3例为左肺癌。临床分期:T2-3N1-2M0期(n=8)和T4N2M0期(n=5)(表1)。本研究符合甘肃省武威肿瘤医院临床试验伦理委员会所制定的伦理学标准,伦审号:2021-伦理审查-36,受试患者有完整的临床资料并取得患者知情同意。
1.2仪器设备
本研究主要通过连接实时体部监测系统RPM的飞利浦Brilliance CT Big Bore大孔径CT对患者进行4D-CT技术模拟定位。光子放疗计划系统采用瓦里安Eclipse15.5,放疗实施设备为瓦里安Vital Beam加速器,该设备具有40对0.5 cm宽和20对1.0 cm宽MLC叶片以及CBCT影像配准系统。武威碳离子医用加速器HIMM由中国科学院兰州近代物理研究所研发,配置放射治疗计划系统ci-Plan由近物所自主研发,适用于高能碳离子束放射治疗计划设计。
1.3 治疗计划
为了制定治疗计划,扫描2.5 mm厚的自由呼吸计算机断层扫描(CT)图像。总肿瘤体积(GTV)包括原发肿瘤和临床阳性淋巴结。临床上阳性淋巴结定义为CT图像或正电子发射断层扫描CT阳性淋巴结中≥1 cm的淋巴结。临床靶体积(CTV)包括GTV和预防性淋巴结引流区,使用国际肺癌研究协会的淋巴结图将其定义为同侧肺门和纵隔淋巴结区域[12]。计划靶体积PTV1被定义为CTV基础上各个方向外扩5 mm,同时考虑了器官运动和摆位错误。PTV2不包括预防性淋巴结区域,PTV2被定义为GTV外扩5毫米的摆位误差。使用RTOG 1106 OAR Atlas[13],将肺、脊髓、食道、骨(肋骨、锁骨和椎骨)和“气管和近端支气管树(气管和PBT)”轮廓勾画为高危器官。患者的靶区处方剂量相同,碳离子采用二维放射治疗计划,其原理为利用扫描磁铁将笔形束流横向扩展获得照射场,通过多叶准直器在束流方向上使靶区适形,通过射程移位器调节束流能量来改变束流Bragg峰在体内的深度,脊形过滤器将单能束流尖锐的Bragg峰在纵向展宽到与肿瘤厚度一致的展宽Bragg峰(spread out Bragg peak,SOBP),体表补偿器使SOBP的后沿与肿瘤靶区最深处边缘吻合。光子采用容积旋转调强治疗计划。在碳离子和X射线放射疗法治疗计划中使用了相同的靶区和危及器官。靶区勾画原则遵循了国际辐射单位和测量委员会(ICRU)第50、62、83号报告的建议。
使用ci-Plan计算碳离子被动束均匀扫描照射的剂量分布,PTV1的剂量为Gy(RBE),PTV2同步给予72 Gy(RBE)的处方剂量。碳离子放射治疗的剂量表示为Gy(RBE),定义为物理剂量(Gy)乘以碳离子的RBE。采用水平束流90°和垂直束流0°二野放疗。碳离子危及器官限量参考离子治疗全身各危及器官剂量限制[14],脊髓Dmax<30 Gy(RBE),心脏和心包V40(RBE)<40%,V30(RBE)<50%。双肺Dmean<14 Gy(RBE),单个肺V20(RBE)<20%,V10(RBE)<30%,V5(RBE)<40%。食管Dmax<60 GyE。VMAT计划:使用Eclipse15.5计算X射线剂量分布,PTV1的剂量为Gy,PTV2同步给予72 Gy的处方剂量,光子放射治疗的剂量表示为Gy,定义为物理剂量(Gy)乘以光子的RBE(RBE=1.0)。使用共面双弧旋转调强技术,机架旋转角度:顺时针和逆时针角度分别为181°-179°、179°-181°。光子危及器官限量参考QUANTEC相关报告剂量限制[15-16],脊髓Dmax≤45 Gy,心脏V30≤40%,V40≤30%,双肺V5≤60%,V20≤30%,V30≤20%。使用约束条件实施逆向优化。图1显示了碳离子和X射线放疗典型剂量分布。
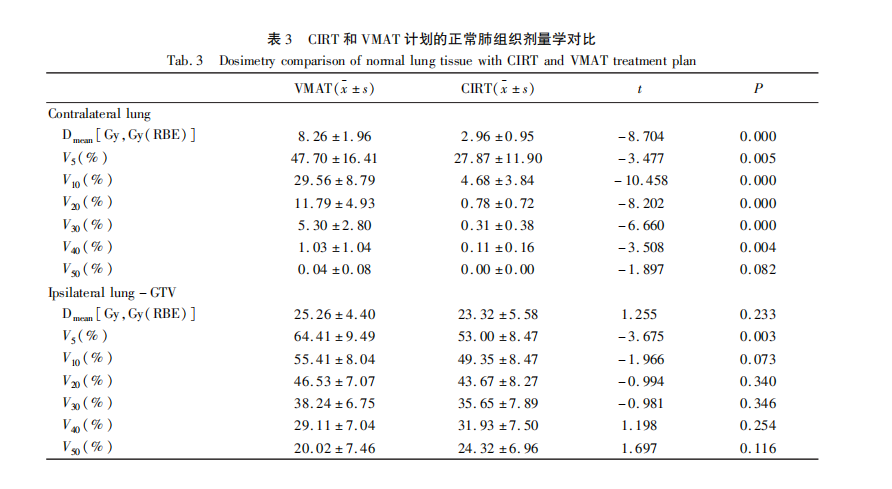
评估了以下剂量参数:靶区覆盖D2、D50、D95、D98的剂量和PTV的均匀性指数(HI)。根据ICRU指南,使用以下公式计算HI:HI=(D2%-D98)/D50[17],其中D2为2%的PTV体积所接受的剂量,D98为98%的PTV体积所受到的剂量,D50为50%的PTV体积所接受的剂量,HI指数越接近于0,均匀性指数越好[18]。我们还评估了:脊髓最大剂量(Dmax);食管平均剂量(Dmean)和V50;骨骼V10、V30和V50;以及气管和PBT V40和V50。由于胃、小肠等器官受照剂量小,差异不明显不做统计,这里主要研究肺脏的受量,评估了健侧肺以及不包括GTV患侧肺的平均剂量(Dmean),低剂量区域(V5和V10)和高剂量区域(V20、V30、V40、V50)及脊髓、食管、骨、气管和PBT等危及器官受量。比较两种计划剂量体积直方图与剂量分布,最大剂量点位于GTV,而非正常组织内,正常器官都未超过耐受剂量。
1.4 统计学处理
采用SPSS 22.0软件进行统计分析,数据统计描述采用均数±标准差表示,行t检验或非参数检验,P<0.05具有统计学意义。
2.结 果
2.1 靶区的剂量覆盖和剂量分布的比较
所有13例患者的CIRT和VMAT计划都充分覆盖了PTV,并符合我们的要求。图1显示了CIRT和VMAT计划在满足100%处方剂量覆盖95%靶区体积的前提下,在横断面剂量分布的典型对比,靶区范围内处方剂量基本相同。健侧肺CIRT计划较VMAT计划低剂量辐射区范围明显减小(图1A),CIRT计划仅可见Bragg峰后“拖尾”效应引起的小范围低剂量区域(图1B)。
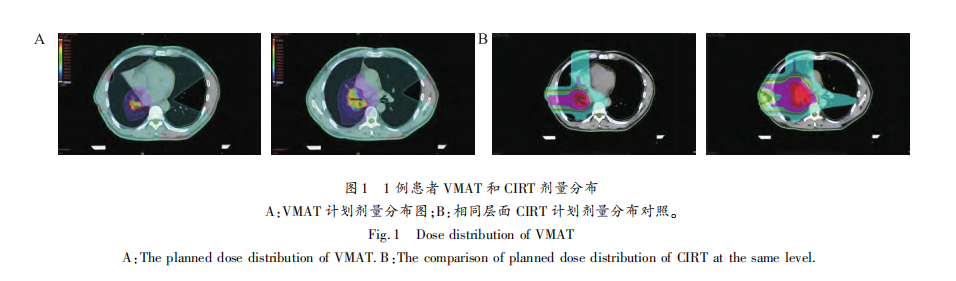
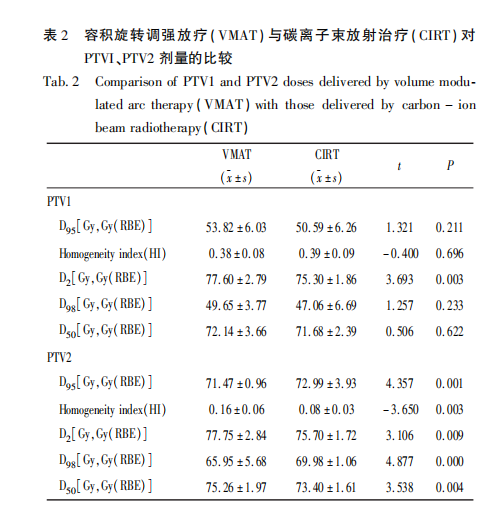
表2显示了PTV的DVH,两种治疗PTV1的D95、D98、D50无统计学差异,PTV1的HI无统计学差异(CIRT vs VMAT:0.39 vs 0.38,P=0.696)。与VMAT相比,CIRT的D2较低[CIRT vs VMAT:75.30 Gy(RBE) vs 77.60 Gy,t=3.693,P=0.003],根据ICRU83号报告建议由于点剂量计算误差大,建议用D2(Near Maximum)代替Dmax,由此可见CIRT计划剂量热点较光子计划低。PTV2两种方案在D95、D98、D50、D2均有统计学差异,PTV2采用CIRT的D95优于VMAT[CIRT vs VMAT:72.99 Gy(RBE) vs 71.47 Gy,t=4.357,P=0.001]。PTV2采用CIRT的HI也优于VMAT(CIRT vs VMAT:0.08 vs 0.16,t=-3.650,P=0.003)。
2.2 危及器官的剂量比较
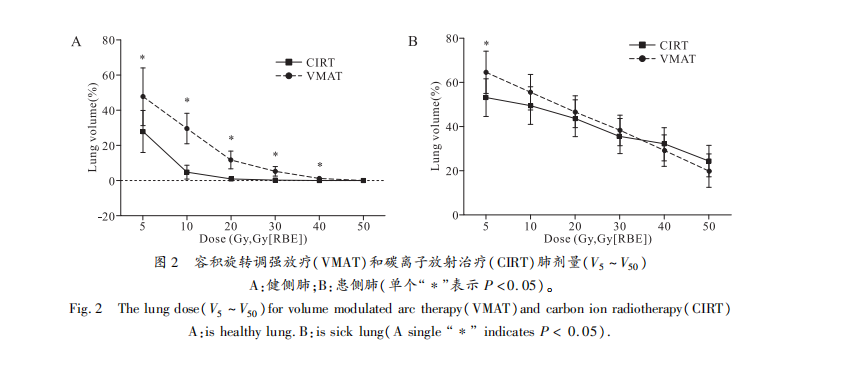
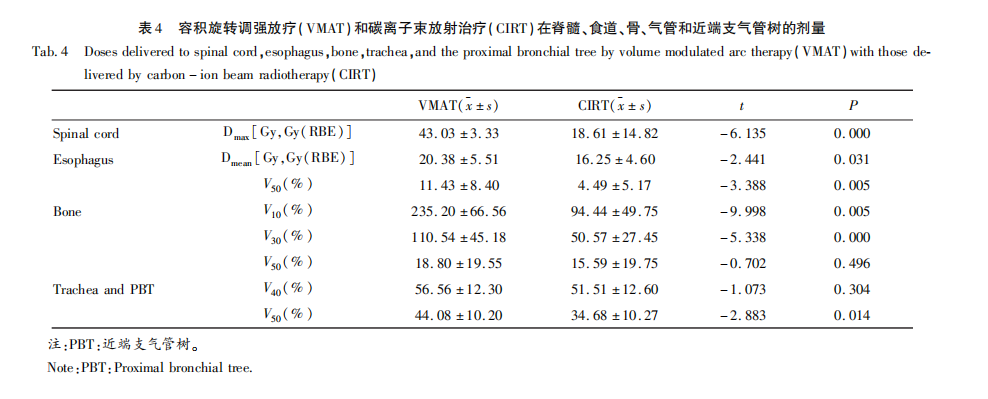
健侧肺中CIRT计划V5、V10、V20、V30、V40、Dmean的剂量明显低于VMAT计划,具有统计学差异(图2A,表3),V50两种计划均较低,无统计学差异(CIRT vs VMAT:0.00 Gy vs 0.04 Gy,P=0.082)。患侧肺-GTV中CIRT的V5低于VMAT(CIRT vs VMAT:53.00 Gy vs 64.41 Gy,t=-3.675,P=0.003),V10、V20、V30、V40、Dmean两种计划均无统计学差异(图2B,表3)。其它危及器官的剂量比较见表4,CIRT计划中脊髓Dmax明显低于VMAT计划(CIRT vs VMAT:18.61 Gy vs 43.03 Gy,t=-6.135,P=0.000);CIRT计划中食管Dmean(CIRT vs VMAT:16.25 Gy vs 20.38 Gy,t=-2.441,P=0.031)、食管V50(CIRT vs VMAT:4.49 Gy vs 11.43 Gy,t=-3.388,P=0.005)低于VMAT计划,有统计学意义(P<0.05);骨V10、V30以及气管和PBT的V50在CIRT计划低于VMAT计划(P<0.05)。两种放疗方法的气管和PBT V40和骨V50无显著性差异。
3.讨 论
肺部肿瘤被正常肺组织、食管、心脏、脊髓、肋骨、神经、肌肉及皮肤等包绕,在常规光子放疗过程中,放射路径上的放射性损伤是一个不容忽视的问题。
美国放射肿瘤学协作组(Radiation Therapy Oncology Group, RTOG)一项前瞻性研究中发现,放射性肺损伤、心脏疾病、食管炎和脊髓炎是中晚期NSCLC放疗的主要剂量限制因素[19]。有研究表明,Ⅲ期NSCLC采取标准治疗X线放疗与同步化疗相结合,局部复发率仍高达30%[20-21]。
RTOG 0617进行了Ⅲ期非小细胞肺癌光子放疗剂量递增的研究,结果显示,74 Gy高剂量组不仅没有比60 Gy组获得更长的中位生存期(20.3月vs 28.7月,P=0.0042),反而起到伤害作用,高剂量组显示了更高的放射性食管炎和Ⅲ度及以上的放射性肺炎发生率[22]。COX等认为光子高剂量组的负性效应可能与心肺毒性有关[23],高剂量组患者的临床结局比标准剂量组更差。在Ⅲ期NSCLC普通光子放疗中,若再增加靶区处方剂量,势必增加严重的并发症而降低生存期。如何在增加靶区处方剂量的同时,不增加甚至降低危及器官受量,这就不得不提到粒子放疗中碳离子放射治疗的优势。
碳离子具有优越的生物学及物理学优势,射线进入肿瘤后,能在很短的时间内沉积大量能量,形成狭窄而尖锐的布拉格峰,具有锐利的横向半影,之后能量迅速衰减,对肿瘤后方的正常组织散射少。日本国立放射线综合研究所(NIRS)进行了局部晚期非小细胞肺癌(LA-NSCLC)CIRT治疗的前瞻性非随机Ⅰ/Ⅱ期临床试验,接受高剂量72 GyE碳离子治疗没有产生Ⅲ-Ⅴ级的毒性反应。2年局部控制率(LCR)和总生存率(OS)分别为93.1%和51.9%,显示了较单纯光子放疗更为显著的生存获益[24]。鉴于此项研究我们对Ⅲ期非小细胞肺癌采用高处方剂量72 Gy(RBE),从剂量学方面探讨和阐述碳离子放疗的优势和治疗价值。
本研究表明,2D-CIRT计划与VMAT计划均满足处方剂量要求。由于是二维计划,CIRT计划PTV1靶区均匀性与光子VMAT计划无差异(表2),但CIRT计划中PTV2的HI是VMAT(表2)的一半(0.08 vs 0.16,P=0.003),这意味着PTV2的最大和最小剂量之间的差距减半,CIRT提供了PTV2接近处方剂量的最低剂量。虽然VMAT是以图像引导调强放射治疗(image guided radiation therapy, IGRT)为基础研发的集医用加速器系统、容积影像系统、成像系统、剂量验证系统、高精度治疗床系统和逆向治疗计划设计软件于一体的先进的放射治疗技术[25-26],能提升靶区的均匀性,降低危及器官受照剂量[27-28]。但2D-CIRT计划可将PTV完美嵌合在碳离子束Bragg峰区,入射路径和峰后剂量跌落较快,而本项研究中PTV2剂量从72跌落至48,CIRT较VMAT技术更易实现。这表明CIRT可以提供肿瘤组织的剂量均匀分布,即使它们被正常组织包围。
放射性肺炎是肺癌放化疗的主要毒性之一,严重的放射性肺损伤可能会致命。国内杨玉洁等叙述性综述[29]表明肺V20是一个重要因素,在肺V20<20%、21%~25%、26%~30%和>31%的患者中,2级以上放射性肺炎发生率分别为8.7%、18.3%、51%和85%。可见V20微小差异,就能对临床产生巨大影响。本研究显示,健侧肺或患侧肺V20在CIRT和VMAT之间的绝对差值为11.01%和2.86%,V5比VMAT低19.83%和11.41%,可见CIRT对双肺的保护明显优于VMAT。MARKS等人的研究[30],肺平均剂量是预测放射性肺炎的一个简明而有效的指标,将本研究的数据健侧肺平均照射剂量(mean lung dose, MLD)绝对差值为5.3 Gy(RBE)带入他们研究中的指数函数公式。预测CIRT的放射性肺炎发生率为2.94%,VMAT的发生率为5.58%,碳离子治疗计划引起放射性肺炎的风险更低。
食管与肺组织解剖关系紧密,非小细胞肺癌放疗中,放射性食管炎是一个重要的并发症,影响患者近期生活质量,从而影响治疗的依存性。食管平均剂量和V50可用于预测放射性食管炎的发生[31]。本研究中CIRT食管平均剂量较光子VMAT计划低20%,V50低60.7%。CIRT计划的脊髓、骨(V10、V30)、气管和PBT(V50)等组织的受照剂量也明显低于光子VMAT计划。主要原因是碳离子具有尖锐的布拉格峰,之后能量迅速衰减,对肿瘤后方的正常组织散射少,可更好的保护正常组织。
本研究中,非小细胞肺癌的2D-CIRT计划较VMAT计划患侧肺的V40、V50、MLD,骨的V50,气管和PBT的V40,没有体现出靶区剂量分布的优势,这与被动束均匀扫描相关。均匀扫描时,束流通过脊型过滤器将Bragg峰纵向扩展至合适大小,再通过计划系统(TPS)计算将展宽的Bragg峰准确落于肿瘤上,实现被动式治疗。往往要求在射野方向上位于肿瘤后方的正常组织不受或者少受照射,因此需要根据靶区分布制作组织补偿器,将展宽后落于肿瘤后方的剂量通过补偿器的调节移除。处于碳离子束贯穿深度上的部分正常组织也不可避免地受到与肿瘤靶区相当剂量的照射,加之目前我中心碳离子治疗计划为被动束均匀扫描二维计划,射野路径固定且射野方向少,计划系统没有逆向优化功能,靶区剂量的调制能力和计算精度都有待提高,未能充分发挥碳离子的优势。目前我中心碳离子点扫描束斑优化已完成,碳离子治疗的危及器官受量将进一步降低。
综上所述,与光子容积调强放射治疗(VMAT)相比,碳离子二维放射治疗(2D-CIRT)计划在靶区剂量覆盖、均匀性以及保护正常组织、降低毒性反应等方面有更显著的优势,可作为Ⅲ期非小细胞肺癌一种安全、有效、毒副作用小的首选放疗方式。
【参考文献】
[1] FREDERIE B, RAY B, JACQUES E, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2018, 68(6): 394-424.
[2] YANG D, LIU Y, BAI C, et al. Epidemiology of lung cancer and lung cancer screening programs in China and the United States[J]. Cancer Lett, 2020, 468(1): 82-87.
[3] MITHWANI H, FEBBRARO M. Non-small-cell lung cancer in 2022: A review for general practitioners in oncology[J]. Curr Oncol, 2022, 29(3): 1828-1839.
[4] BAEK WY, BRAUNROTH T, ROSALES LD LF, et al. Stopping power of water for carbon ions with energies in the Bragg peak region[J]. Phys Rev E, 2020, 102(6): 81-90.
[5] UENO K, MATSURA T, HIRAYAMA S, et al. Physical and biological impacts of collimator-scattered protons in spot-scanning proton therapy[J]. J Appl Clin Med Phys, 2019, 20(7): 48-57.
[6] WANG L, HU J, LIU X, et al. Intensity-modulated carbon-ion radiation therapy versus intensity-modulated photon-based radiation therapy in locally recurrent nasopharyngeal carcinoma: A dosimetric comparison[J]. Cancer Manag Res, 2019, 11(8): 7767-7777.
[7] CHATZIPAPAS KP, PAPADIMITRIOU P, EMFIENTZOGLOU D, et al. Ionizing radiation and complex DNA damage: Quantifying the radiobiological damage using Monte Carlo simulations[J]. Cancers (Basel), 2020, 12(4): 799-809.
[8] BUGLEWICZ DJ, WALSH KD, HIRAKAWA H, et al. Biological effects of monoenenergetic carbon ions and their associated secondary particles[J]. Front Oncol, 2022, 12(2): 17-28.
[9] PARK JM, KIM JI, WU HG. Technological advances in charged-particle therapy[J]. Cancer Res Treat, 2021, 53(3): 635-640.
[10] MOHAMAD O, YAMADA S, DURANTE M. Clinical indications for carbon ion radiotherapy[J]. Clin Oncol, 2018, 30(5): 317-329.
[11] GOETZ G, MITIC M, MITTERMAYER T, et al. Health technology assessment of carbon-ion beam radiotherapy: A systematic review of clinical effectiveness and safety for 54 oncological indications in 12 tumour regions[J]. Anticancer Res, 2019, 39(4): 1635-1650.
[12] GOLDSTRRAW P, CHANSKY K, CROWLEY J, et al. The IASLC lung cancer staging project: Proposals for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer[J]. J Thorac Oncol, 2016, 11(1): 39-51.
[13] KONG FM, RITTER T, QUINT DJ, et al. Consideration of dose limits for organs at risk of thoracic radiotherapy: Atlas for lung, proximal bronchial tree, esophagus, spinal cord, ribs, and brachial plexus[J]. Int J Radiat Oncol Biol Phys, 2011, 81(5): 1442-1457.
[14] ZHANG Q, KONG L, LIU R, et al. Chinese ion therapy guidelines (Version 2020)[J]. Precision Radiation Oncol, 2021, 11(3): 1-11.
[15] MARKS LB, BENTZEN SM, DEASY JO, et al. Radiation dose-volume effects in the lung[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3): 70-76.
[16] KIRKPATRICK JP, KOGEL A, SCHULTHEISS TE. Radiation dose-volume effects in the spinal cord[J]. Radiother Oncol J Eur Soc Ther Radiol Oncol, 1993, 76(3): 42-49.
[17] HODAPP N. The ICRU Report 83: Prescribing, recording and reporting photon-beam intensity-modulated radiation therapy (IMRT)[J]. Strahlenther Onkol, 2012, 188(1): 97-99.
[18] CREEMERS IH, KUSTER JAM, VAN KOLLENBURG PG, et al. Comparison of dose metrics between automated and manual radiotherapy planning for advanced non-small-cell lung cancer with volumetric modulated arc therapy[J]. Phys Imaging Radiat Oncol, 2019, 18(9): 92-96.
[19] RAHMAN MV, PURDY JA, EMMA B, et al. Clinical dose-volume histogram analysis for pneumonitis after 3D treatment for non-small-cell lung cancer (NSCLC)[J]. Int J Radiat Oncol Biol Phys, 1999, 45(2): 3232-3239.
[20] CURRAN WJ, PAULUS R, LANGER CJ, et al. Sequential vs. concurrent chemoradiation for stage III non-small-cell lung cancer: Randomized phase III trial RTOG 9410[J]. J Natl Cancer Inst, 2011, 103(19): 1452-1460.
[21] RODRIGUEZ DE DIOS N, NAVARRO-MARTIN A, CIGARRAL C, et al. GOECP/SER radiotherapy guidelines for non-small-cell lung cancer[J]. Cancer Radiother, 2022, 13(4): 317-318.
[22] BRADLEY PJ, REBECCA PAULUS BS, KOMAKI PR, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): A randomized, two-by-two factorial phase 3 study[J]. Lancet Oncol, 2015, 16(2): 187-199.
[23] COX JD. Are the results of RTOG 0617 mysterious?[J]. Int J Radiat Oncol Biol Phys, 2012, 82(3): 1042-1044.
[24] TAKAHASHI W, NAKAJIMA M, YAMAMOTO N, et al. A prospective non-randomized phase I/II study of carbon ion radiotherapy in a favorable subset of locally advanced non-small-cell lung cancer (NSCLC)[J]. Cancer, 2015, 121(8): 1321-1327.
[25] AKCAY M, ETIZ D, DURURER K, et al. Dosimetric comparison of single-arc/partial-arc volumetric modulated arc therapy and intensity-modulated radiotherapy for peripheral and central lung cancer[J]. J Cancer Res Ther, 2021, 17(1): 80-87.
[26] CHOW J, JIANG R, KICIAK A, et al. Dosimetric comparison between the prostate intensity-modulated radiotherapy (IMRT) and volumetric-modulated arc therapy (VMAT) plans using the planning target volume (PTV) dose-volume factor[J]. J Radiother Pract, 2016, 15(03): 263-268.
[27] YU CX, TANG G. Intensity-modulated arc therapy: Principles, technologies and clinical implementation[J]. Phys Med Biol, 2011, 56(5): 31-54.
[28] ZHANG W, LI GP, XIN HY. New technique in tumor radiotherapy - volumetric intensity-modulated arc therapy[J]. Clin Eng, 2011, 26(12): 104-105.
[29] YAN Y, FU J, KOWALCZUK RO, et al. Exploration of radiation-induced lung injury, from mechanism to treatment: A narrative review[J]. Transl Lung Cancer Res, 2022, 11(2): 307-322.
[30] MARKS LB, BENTZEN SM, DEASY JO, et al. Radiation dose-volume effects in the lung[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3): 70-76.
[31] YU Y, ZHENG H, LIU L, et al. Predicting severe radiation esophagitis in patients with locally advanced esophageal squamous cell carcinoma receiving definitive chemoradiotherapy: Construction and validation of a model based on clinical and dosimetric parameters as well as inflammatory indices[J]. Front Oncol, 2021, 24(11): 82-87.
初审:张洁 复审:张莉红
