碳离子被动束扫描放疗与光子调强放射治疗15例前列腺癌的剂量学比较
碳离子治疗头颈部腺样囊性癌疗效观察并文献复习
李小军 1 ,柴鸿钰 1 ,张雁山 1 ,周俊年 2 ,胡廷朝 1 ,马淑萍 1 ,张天娥 1 ,王艳 1 ,王健 1
1. 甘肃省武威肿瘤医院重离子放疗病区,甘肃 武威 733000;2. 甘肃省武威肿瘤医院头颈外科,
甘肃 武威 733000
通信作者 :柴鸿钰,E-mail :1107530307@qq.com
摘要 :目的 探讨碳离子治疗头颈部腺样囊性癌(adenoid cystic carcinoma,ACC)的优势。方法 回顾性报道 2020 年 3 月至 2021 年 6 月在甘肃省武威肿瘤医院武威重离子中心(Wuwei Heavy Ion Center,WWHIC)接受碳离子放疗的 5 例头颈部 ACC 患者的病例资料,分析治疗疗效和不良反应。碳离子剂量定义为物理剂量乘以碳离子相对生物学有效性(relative biological effectiveness,RBE), 用 Gy(RBE) 表 示, 均 为 RBE 为 3.0 时 的 剂 量。 靶 区 处 方 剂 量 为 64.0~68.0 Gy(RBE)/16~17 Fx。
结果 5 例患者均完成碳离子治疗,平均随访 16.6 个月(13~20 个月)。随访至 12 个月时,1 例达到完全缓解(complete response,CR),3 例达到部分缓解(partial response,PR),1 例因治疗后 6 个月出现肺部转移评价为疾病进展(progressive disease,PD)。1 年总生存(overall survival,OS)率为 100.0%,1 年局部控制(local control,LC)率为 100.0%,1 年无进展生存(progression-free survival,PFS)率为 80.0%。1 例发生 2 级急性口腔黏膜反应。1 例发生 1 级口干的放疗晚期不良反应。 所有患者均未发生≥3 级不良反应。结论 碳离子放疗应用于不可手术切除、术后残留及复发的头颈部 ACC 可获得良好的 OS 和 LC,且不良反应可耐受。
关键词 :腺样囊性癌 ;头颈部 ;碳离子治疗 ;疗效 ;不良反应
腺样囊性癌(adenoid cystic carcinoma,ACC)因病理形态表现为上皮团块中的玻璃样物质,似圆柱状,又称圆柱瘤 (cylindroma) 或圆柱瘤型腺癌 (adeno-carcinoma of cylindroma type)。ACC 于 1859 年首次被提出,是临床上较少见的恶性肿瘤类型。有报道称,ACC 年发病率为(3.0~4.4)/10⁶,该病以头颈部发病率最高,约占头颈部恶性肿瘤的 1%[1],好发于小涎腺、舌下腺、腮腺和颌下腺等,在涎腺恶性肿瘤中占 24%[2];也可能发生在鼻咽部、口底、支气管和咽旁间隙等,但发病率较低 [3]。男女发病率无较大差异,较多见于 40~60 岁 [4]。
由于发病位置隐蔽,侵袭性强,头颈部 ACC 因与口、鼻、眼及颅底毗邻,可引起周围多器官病损。头颈部 ACC 肿瘤浸润性极强,与周围组织无界限,肉眼观察正常的组织,在显微镜下常见肿瘤细胞浸润,有时甚至是跳跃性的。ACC 是一种进展较为缓慢的恶性肿瘤,容易出现神经侵犯和血管侵入造成血道转移 [5]。这些临床特性使得该病就诊时常已是晚期,故容易漏诊和误诊,治愈率较低,且治疗后远期疗效不佳。手术是头颈部 ACC 的主要治疗方法,在足够的安全范围内进行完全切除通常是不可行的,手术治疗的 10 年局部控制(local control,LC)率仅为 60%,在切缘阳性的患者中甚至 <30%[6-7]。部分肿瘤由于侵犯亚临床结构较多,位于多个功能区,常无法手术切除或根治性手术损毁大,仅可行姑息性减瘤手术,术后易复发。因此根治性放疗成为 ACC 多学科管理的重要组成部分。ACC 属辐射抗拒性肿瘤。研究发现,放疗剂量增加与 LC 率成正相关,但常规光子放疗剂量的增加往往受到周围危及器官的耐受剂量限制 [8]。一项研究表明,光子放疗后 ACC 5 年总生存(overall survival,OS)率仅为 37.3%,ACC 对常规光子放疗具有抵抗特性 [9],因此需要一种更有效的治疗方法在提高 ACC 的 LC 率和 OS 率的同时更好保护病灶周围的正常器官。甘肃省武威肿瘤医院武威重离子中心(Wuwei Heavy Ion Center,WWHIC)碳离子治疗系统于 2020 年 3 月正式应用于临床。本文报道本中心使用碳离子治疗的 5 例头颈部 ACC 的临床效果和安全性,包括 LC、OS、无进展生存期(progression-free survival,PFS)和相关不良反应。
1 资料与方法
1.1 一般资料
选取 2020 年 3 月至 2021 年 6 月在本中心接受碳离子治疗的 5 例经病理学证实的头颈部 ACC 患者。治疗前均进行头颈部增强 MRI、增强 CT 和 PET/CT 等诊断性检查。患者年龄 35~77 岁,平均年龄 57.2 岁(表 1)。原发部位为上颌窦 2 例,鼻腔 1 例,腮腺 1 例,鼻窦 1 例;其中Ⅱ期 1 例,Ⅲ期 1 例,ⅣA 期 2 例,ⅣB 期 1 例。病例 1 为术后复发,病例 2~3 为术后残留,病例 4~5 为不可手术切除。美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)一般状态评分均为 0~1 分。本研究已通过本院临床试验伦理委员会审批(伦审号:甘肃省武威肿瘤医院伦理审查 2020-28)。所有病例均有完整的临床资料并取得患者知情同意。
1.2 治疗方法和设备
所有患者在治疗前均完成头颈部增强 MRI、增强 CT 和 PET/CT 等相关检查,经本中心多学科会诊后制定个体化碳离子治疗方案。CT 定位设备为飞利浦 Brilliance CT Big Bore 大孔径 CT(PHILIPS,荷兰)。武威碳离子医用加速器 HIMM 由中国科学院兰州近代物理研究所研发。放射治疗计划系统 ciPlan 碳离子放疗计划系统(Treatment Plan System,TPS;版本 V1.0)由中国科学院兰州近代物理研究所自主研发,适用于高能碳离子束放射治疗计划设计。
1.2.1 模拟定位方法
采用仰卧位,张口含口塞,将舌体压于口塞下,减少舌体受照面积和通过张口减少口腔黏膜受照面积。根据患者具体情况个性化选择头枕,将头颈部根据病灶部位调整角度,进行热塑膜固定。在完成模具制作后进行定位 CT 扫描,扫描范围为颅顶至气管分叉层面,扫描要求 1 mm 薄层 CT,隔日进行定位 MRI 扫描,要求带模具及口塞进行薄层 1 mm MRI 扫描。扫描结束后将定位 CT 及 MRI 融合后参照头颈部碳离子靶区勾画原则进行靶区勾画,常规使用 MRI 来识别肿瘤,必要时参照 PET/CT。靶病灶疗效判定最大径测定基于 MRI 增强。
1.2.2 靶区勾画方法
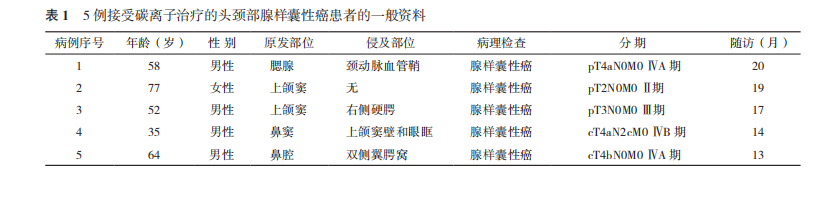
原发肿瘤体积(gross tumor volume,GTV)包括增强 MRI 和(或)PET/CT 检查所显示的肿瘤病灶,包括咽后淋巴结。颈部转移淋巴结(GTV node,GTVnd)勾画为增强 MRI 和(或)PET/CT 检查所显示的颈部转移淋巴结。计划靶体积增量区(planning target volume boost,PTVboost)被定义为 GTV 和 GTVnd 基础上各个方向外扩 5 mm。临床靶体积(clinical target volume,CTV)包括 GTV 在三维方向外扩 3~5 mm 及基于手术及组织病理报告与 MRI 或增强 CT 图像所提示并根据肿瘤生物学行为所确定的亚临床病灶范围,ACC 易沿神经侵犯,故应包括肿瘤所处部位神经及其通路,直至颅底或颅内。常规不进行淋巴结引流区预防性照射,对已有颈部淋巴结转移的患者,需行该区域淋巴结引流区域的预防性照射。计划靶体积(planning target volume,PTV)被定义为 CTV 基础上各个方向外扩 3 mm,同时考虑器官运动和摆位误差。碳离子剂量定义为物理剂量乘以碳离子相对生物学有效性(relative biological effectiveness,RBE),用 Gy(RBE)表示,均为 RBE 为 3.0 时的剂量。采用分段给量方式,使用 ci-Plan 计算碳离子被动束均匀扫描照射的剂量分布,第 1 程计划 PTVboost 为 8~12 Gy(RBE)/2~3 Fx,第 2 程 PTV 为 54 Gy(RBE)/14 Fx。5 例患者的肿瘤处方剂量为 64.0~68.0 Gy(RBE)/16~17 Fx。碳离子危及器官限量参考离子治疗全身各危及器官剂量限制 [10],脑干最大剂量(maximum dose,Dmax)<45 Gy(RBE),脑干 1 mL 体积受照剂量(D1)≤38.5 Gy(RBE);晶状体 D1<6 Gy(RBE);视通路 20 mL 体积受照剂量(D20)<30 Gy(RBE);脊髓 Dmax<30 Gy(RBE),D1≤31.5 Gy(RBE);腮腺双侧平均剂量(mean dose,Dmean)<21 Gy(RBE),单侧 Dmean<18 Gy(RBE)。图 1 显示 1 例诊断为腮腺 ACC 患者的碳离子治疗剂量分布图。
1.3 随访计划
碳离子放疗完成后 3 个月进行疗效评估,检查项目包括相关部位的 MRI、CT 和实验室检查等,图 1 病例 1 腮腺腺样囊性癌患者碳离子治疗剂量分布图。治疗后 18 个月内每 3 个月复查 1 次 CT 或 MRI,18 个月~3 年每半年随访 1 次,每年进行 1 次 PET/CT 检查。从碳离子放疗第 1 天开始计算 OS 和 PFS。根据临床症状、体征和检验检查结果,参照常见不良事件评价标准 5.0 版(Common Terminology Criteria for Adverse Events Version 5.0,CTCAE v5.0)和欧洲癌症治疗研究组(European Organization for Research and Treatment of Cancer,EORTC)/美国肿瘤放射治疗协作组织(Radiation Therapy Oncology Group,RTOG)放射损伤分级标准评价随访期间急性和晚期不良反应 [11-12];根据实体肿瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1 版对肿瘤疗效进行评价 [13]。
2 结 果
2.1 疗效评价
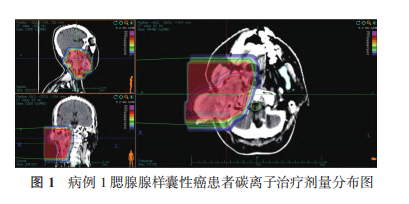
5 例患者均完成碳离子治疗,目前平均随访期 16.6 个月(13~20 个月)。随访至 12 个月时,病例 1 达到完全缓解(complete response,CR;图 2~3),病例 2、3 和 5 达到部分缓解(partial response,PR)。病例 4 鼻窦 ACC 患者治疗前已有双侧颈部Ⅱ区淋巴结转移,在治疗后 6 个月出现肺部转移疾病进展,疗效评价为疾病进展(progressive disease,PD),目前生存。分析 PD 原因为碳离子治疗前已出现颈部淋巴结转移,建议碳离子治疗后规律进行全身静脉化疗,但患者未按时执行。5 例患者 1 年 OS 率为 100.0%,1 年 LC 率为 100.0%,1 年 PFS 率为 80.0%。
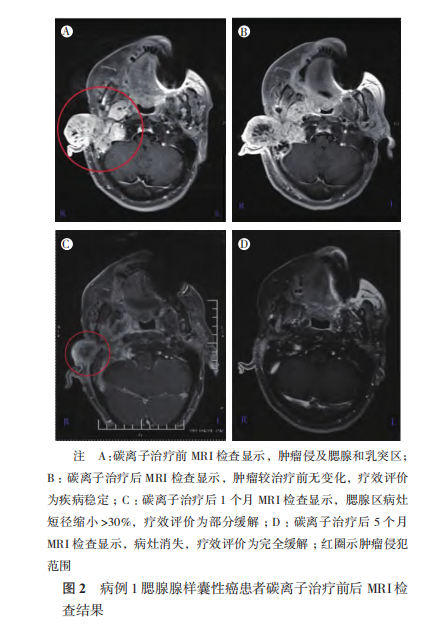
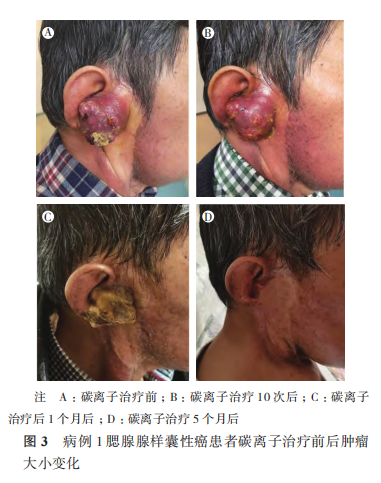
2.2 放疗急性和晚期不良反应
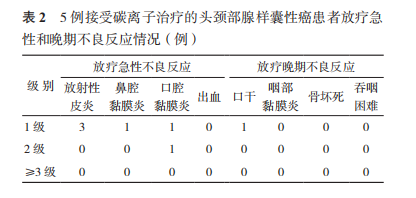
所有患者未发生≥3 级的放疗相关的不良反应(表 2)。急性反应多出现在治疗中和治疗后 2 周之内,表现为放射性皮炎和鼻腔/口腔黏膜炎。1 例(病例 4)发生 2 级口腔黏膜反应,表现为中度疼痛伴溃疡,需要进食流质。在放疗晚期不良反应方面,观察到 1 例(病例 3)口干,出现在放疗结束 3 个月后,表现为口干、味觉减退及唾液黏稠和分泌减少。
3 讨 论
头颈部 ACC 的典型特征是不可预测和缓慢的病程,解剖关系复杂,容易局部复发[14]。手术治疗时需要广泛的局部切除,由于需要保留重要器官,无法获得足够的切缘,且 ACC 容易侵犯血管神经和出现弥漫性浸润,对于切缘较近和无法手术的患者,需术后放疗或根治性放疗。ACC 患者的放疗方式仍以光子治疗占主导地位,但 ACC 光子治疗后容易局部复发,主要原因通常包括肿瘤靶区照射范围不足、肿瘤内存在放射不敏感的细胞群或肿瘤处于导致放射不敏感的环境(如乏氧)等。再程放疗是局部复发 ACC 患者的最为有效的根治手段,但对于再程光子不敏感的肿瘤患者,疗效仍不理想,2 年 LC 率 <50%,5 年 LC 率 <40%。近年来,随着医疗设备的进步,质子和碳离子等一些新型的放疗技术运用到临床[15]。相对于 X 线来说,由于质子束和碳离子束具有更好的物理剂量学优势,尤其是碳离子这种高线性能量传递(linear energy transfer,LET)射线,对常规光子治疗不敏感的肿瘤具有更高的 RBE[16],能提高对肿瘤的杀伤力。碳离子束可以能量沉积成布拉格峰,将剂量集中在目标组织内,在杀死靶区肿瘤细胞的同时,尽可能地保护周围和辐射通道上的正常组织以减少损伤。因碳离子具有对癌细胞杀伤效果好、疗程短、无痛苦和不良反应较低等优势,特别适合于不宜手术、对常规射线不敏感和常规射线治疗后复发的部分实体肿瘤的治疗。因此,碳离子被国际上公认为是 21 世纪最理想的肿瘤放疗设备。
目前碳离子放疗已在临床上应用于治疗对辐射抗拒的颅底、头颈部和脊椎等骨和软组织肿瘤以及胰腺癌和胶质瘤等难治性肿瘤,其疗效确切[17]。日本国立放射学研究所(National Institute of Radiological Sciences,NIRS)早期完成一项碳离子治疗 36 例局部晚期头颈癌患者的Ⅰ和Ⅱ期的剂量递增临床研究[18],该研究纳入 9 例 ACC 患者,处方剂量为 57.6~64.0 Gy(RBE)[单次分割剂量 3.6~4.0 Gy(RBE)/d,4 次/周],靶区仅包括肿瘤病灶外放安全边界(即未给予任何预防性照射),5 年 LC 率为 90%,未见急性 4 级毒性,其中 10% 的病例发生 3 级黏膜炎,10% 发生 3 级皮肤反应。有研究报道 18 例局部晚期舌根 ACC 碳离子治疗结果,总剂量为 57.6~64.0 Gy(RBE),16 次 4 周完成,治疗后 5 年 LC 率和 OS 率分别为 92%和 72%[19]。一项回顾性研究分析 122 例碳离子放疗的头颈部 ACC 患者,其中 2 年 OS 率和 PFS 率为 94% 和 68%[20]。研究显示,2003 年至 2009 年在日本兵库县粒子医疗中心接受质子或碳离子放疗的 57 例不可切除的原发性 ACC 患者 3 年 OS 率为 83%[21]。还有研究显示,2002 年至 2008 年 80 例单独接受质子或碳离子放疗的患者 5 年 OS 率为 63%,5 年 LC 率为 75%[22]。2004 年海德堡大学报告 21 例接受光子联合碳离子放疗的 ACC 患者 3 年 LC 率为 62%,无 >3 级不良反应[23]。上述研究结果与本中心治疗的 5 例头颈部 ACC 的随访结果一致,头颈部 ACC 接受碳离子治疗后具有更高的 LC 率和 OS 率,且急性和晚期不良反应发生率均较低。像 ACC 这样的惰性肿瘤可能对碳离子放疗有更高的反应性。
日本 NIRS 2007 年至 2016 年期间 17 例复发性 ACC 患者再次接受碳离子治疗的临床研究结果显示出 ACC 复发后碳离子再程放疗的可行性[24],所有患者 2 年 LC 率为 40.5%,2 年 PFS 率为 29.4%。其中,37.5% 的患者出现 3 级晚期不良反应,1 例出现 5 级中枢神经系统坏死。该研究提示,碳离子治疗复发的头颈部 ACC,LC 率及 PFS 率较初治时下降,且不良反应加重,但仍可作为一种挽救性治疗手段。
除了头颈部,也有起自气管和乳腺腺体的 ACC 病例报道。气管 ACC(tracheal ACC,TACC)是起源于气管黏液腺的低度恶性肿瘤,占呼吸系统恶性肿瘤总数的 0.04%~0.2%。上海质子重离子医院 2021 年总结 18 例 TACC 碳离子治疗的数据,中位随访时间 20.7 个月,总有效率为 88.2%,5 例在术后 12.2~41.0 个月出现肺转移,1 例在碳离子治疗后 31.9 个月出现局部复发[25],2 年 OS 率、LC 率和 PFS 率分别为 100%、100% 和 61.4%。除 1 例发生 4 级气管狭窄,支架植入后气管狭窄缓解外,所有患者均未观察到 2~3 级不良反应。乳腺 ACC 属于乳腺小腺管状病变,在临床非常罕见,占所有乳腺癌的 0.1%;虽然位于其他部位的 ACC 对于放疗效果佳,但乳腺 ACC 术后是否进行相关放疗也没有一个明确的共识。
虽然本中心病例的观察期不够,临床病例尚在积累中,但在过去的研究报告中,对于 ACC 的各项治疗方法中,碳离子放疗取得较好的 LC 率和 OS 期[26-27]。ACC 碳离子放疗疗效好与碳离子辐射和光子辐射生物相互作用的差异有关。与光子辐射比较,高 LET 辐射的特点是碳离子疗效较好的原因,细胞周期的敏感度变化小,亚致死或潜在致命细胞损伤的修复较少或没有修复。
综上所述,碳离子放疗是一种疗效好且不良反应小的治疗方法,适用于不可切除、术后残留、放疗抵抗或复发的头颈部 ACC 患者。本中心报道的 5 例头颈部 ACC 的碳离子治疗病例取得满意的 1 年 OS 率和 LC 率,且未发生≥3 级不良反应。碳离子治疗可作为 ACC 的主要治疗方法之一。
参考文献:
[1] Coca-Pelaz A, Rodrigo JP, Bradley PJ, et al. Adenoid cystic carcinoma of the head and neck: an update[J]. Oral Oncol, 2015, 51(7): 652-661.
[2] 邱明珠, 徐宝卿, 汤晓晖, 等. 涎腺腺样囊性癌 40 例临床病理特征及预后分析[J]. 临床与实验病理学杂志, 2021, 37(4): 428-433.
[3] Unsal AA, Chung SY, Zhou AH, et al. Sinonasal adenoid cystic carcinoma: a population-based analysis of 694 cases[J]. Int Forum Allergy Rhinol, 2017, 7(3): 312-320.
[4] Atallah S, Casiraghi O, Fakhry N, et al. A prospective multicentre REFCOR study of 470 cases of head and neck adenoid cystic carcinoma: epidemiology and prognostic factors[J]. Eur J Cancer, 2020, 130: 241-249.
[5] 杨子桧. CCL2/CCR2 分子轴在涎腺腺样囊性癌嗜神经侵袭中的作用及机制研究[D]. 西安: 中国人民解放军空军军医大学, 2019.
[6] Cantù G. Adenoid cystic carcinoma. An indolent but aggressive tumour. Part B: treatment and prognosis[J]. Acta Otorhinolaryngol Ital, 2021, 41(4): 296-307.
[7] 李燕, 邓文英, 李宁, 等. 头颈部腺样囊性癌的临床特征治疗策略和预后[J]. 中华肿瘤杂志, 2019, 41(12): 932-936.
[8] Rodriguez-Russo CA, Junn JC, Yom SS, et al. Radiation therapy for adenoid cystic carcinoma of the head and neck[J]. Cancers, 2021, 13(24): 6335.
[9] 杨婧艺, 王德辉. 鼻腔鼻窦腺样囊性癌治疗进展[J]. 中国眼耳鼻喉科杂志, 2019, 19(4): 287-292.
[10] Zhang Q, Kong L, Liu R, et al. Chinese ion therapy guideline (Version 2020)[J]. Precis Radiat Oncol, 2021, 11(3): 1-11.
[11] Freites-Martinez A, Santana N, Arias-Santiago S, et al. Using the common terminology criteria for adverse events (CTCAE-version 5.0) to evaluate the severity of adverse events of anticancer therapies[J]. Actas Dermosifiliogr, 2021, 112(1): 90-92.
[12] Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1341-1346.
[13] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 240-247.
[14] Ouyang DQ, Liang LZ, Zheng GS, et al. Risk factors and prognosis for salivary gland adenoid cystic carcinoma in southern China: a 25-year retrospective study[J]. Medicine, 2017, 96(5): e5964.
[15] 钟江涛, 周水洪. 2023 年第 1 版《NCCN 头颈部癌临床实践指南》更新解读[J]. 实用肿瘤杂志, 2023, 38(3): 203-210.
[16] Grimes DR. Estimation of the oxygen enhancement ratio for charged particle radiation[J]. Phys Med Biol, 2020, 65(15): 15NT01.
[17] Kamada T, Tsujii H, Blakely EA, et al. Carbon ion radiotherapy in Japan: an assessment of 20 years of clinical experience[J]. Lancet Oncol, 2015, 16(2): e93-100.
[18] Mizoe JE, Tsujii H, Kamada T, et al. Dose escalation study of carbon ion radiotherapy for locally advanced head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys, 2004, 60(2): 358-364.
[19] Koto M, Hasegawa A, Takagi R, et al. Evaluation of the safety and efficacy of carbon ion radiotherapy for locally advanced adenoid cystic carcinoma of the tongue base[J]. Head Neck, 2016, 38(1_suppl): E2122-2126.
[20] Sulaiman NS, Demizu Y, Koto M, et al. Multicenter study of carbon-ion radiation therapy for adenoid cystic carcinoma of the head and neck: subanalysis of the Japan Carbon-ion Radiation Oncology Study group (J-CROS) study (1402 HN)[J]. Int J Radiat Oncol, 2018, 100(3): 639-646.
[21] Morimoto K, Demizu Y, Hashimoto N, et al. Particle radiotherapy using protons or carbon ions for unresectable locally advanced head and neck cancers with skull base invasion[J]. Jpn J Clin Oncol, 2014, 44(5): 428-434.
[22] Takagi M, Demizu Y, Hashimoto N, et al. Treatment outcomes of particle radiotherapy using protons or carbon ions as a single-modality therapy for adenoid cystic carcinoma of the head and neck[J]. Radiother Oncol, 2014, 113(3): 364-370.
[23] Schulz-Ertner D, Nikoghosyan A, Thilmann C, et al. Results of carbon ion radiotherapy in 152 patients[J]. Int J Radiat Oncol Biol Phys, 2004, 58(2): 631-640.
[24] Hayashi K, Koto M, Ikawa H, et al. Feasibility of re-irradiation using carbon ions for recurrent head and neck malignancies after carbon-ion radiotherapy[J]. Radiother Oncol, 2019, 136: 148-153.
[25] Chen J, Mao JF, Ma NY, et al. Definitive carbon ion radiotherapy for tracheobronchial adenoid cystic carcinoma: a preliminary report[J]. BMC Cancer, 2021, 21(1): 734.
[26] Lang K, Adeberg S, Harrabi S, et al. Adenoid cystic Carcinoma and Carbon ion Only irradiation (ACCO): study protocol for a prospective, open, randomized, two-armed, phase Ⅱ study[J]. BMC Cancer, 2021, 21(1): 812.
[27] Loap P, Vischioni B, Bonora M, et al. Biological rationale and clinical evidence of carbon ion radiation therapy for adenoid cystic carcinoma: a narrative review[J]. Front Oncol, 2021, 11: 789079.
初审:张 洁
复审:张莉红
